题目内容
升高温度,下列数据不一定增大的是
A.化学反应速率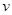 | B. 的溶解度S 的溶解度S |
| C.化学平衡常数K | D.水的离子积常数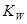 |
C
解析试题分析:A. 化学反应速率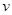 一定增大,错误;B.KNO3的溶解度随温度的升高而增大,所以升高温度KNO3的溶解度一定增大,错误;C. 升高温度,化学平衡向吸热反应方向移动,若正反应是放热反应,则平衡逆向移动化学平衡常数K减小;若正反应是吸热反应,则平衡正向移动化学平衡常数K增大,因此升高温度,化学平衡常数K不一定增大,正确;D. 水是弱电解质,升高温度促进水的电离,因此水的离子积常数
一定增大,错误;B.KNO3的溶解度随温度的升高而增大,所以升高温度KNO3的溶解度一定增大,错误;C. 升高温度,化学平衡向吸热反应方向移动,若正反应是放热反应,则平衡逆向移动化学平衡常数K减小;若正反应是吸热反应,则平衡正向移动化学平衡常数K增大,因此升高温度,化学平衡常数K不一定增大,正确;D. 水是弱电解质,升高温度促进水的电离,因此水的离子积常数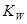 一定增大,错误。
一定增大,错误。
考点:考查温度与化学反应速率、物质的溶解度、化学平衡常数及水的离子积的关系的知识。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l)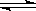 2PbCrO4(s)+ 2H+(aq)△H<0
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
| A.移走部分PbCrO4固体,Cr2O72-转化率升高 |
| B.升高温度,该反应的平衡常数(K)增大 |
| C.加入少量NaOH固体,自然沉降后,溶液颜色变浅 |
| D.加入少量K2Cr2O7固体后,溶液中c(H+)不变 |
在一定温度下的恒容容器中,标志反应A(s)+2B(g) 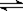 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
| A.混合气体的压强不随时间变化而变化 |
| B.混合气体的密度不随时间变化而变化 |
| C.气体总物质的量不随时间变化而变化 |
| D.单位时间内生成n mol C,同时消耗2n mol B |
在A2+3B2 = 2C的反应中,经过t秒钟后,C的浓度增加了0.6mol/L,在此期间,反应速率V(B2)=0.45mol/(L·S),则t值为
| A.1秒 | B.1.5秒 | C.2秒 | D.2.5秒 |
工业上可利用甲烷除去NO气体,反应为CH4(g)+4NO(g) 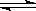 CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.单位时间内消耗CH4和N2的物质的量比为1∶2时,反应达到平衡 |
| C.平衡时,其他条件不变,增加CH4的浓度,氮氧化物的转化率减小 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
已知2SO2(g)+O2(g)  2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
| A.10mol 10% | B.20mol 20% | C.20mol 40% | D.30mol 80% |
可逆反应N2(g)+ 3H2(g) 
 2NH3 (g)达到平衡状态,下列说法中正确的是( )
2NH3 (g)达到平衡状态,下列说法中正确的是( )
| A.该反应停止,N2和H2不再化合 | B.N2、H2、NH3浓度不变 |
| C.N2、H2、NH3浓度相等 | D.N2、H2、NH3的物质的量之比为1:3:2 |
 zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。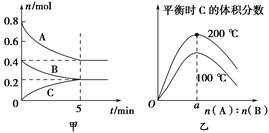
 K(g)+NaCl(l)
K(g)+NaCl(l)