题目内容
8.20mL 5.0mol/L Na2SO4溶液中,溶质的质量是14.2g;此溶液中Na+的物质的量浓度为10mol/L;取出5mL该溶液,5mL该溶液中SO42-物质的量浓度为5mol/L;将20mL 5.0mol/L Na2SO4溶液加水稀释至100mL,则稀释后溶液中Na2SO4物质的量浓度为1mol/L.分析 根据n=cV计算Na2SO4的物质的量,根据m=nM计算Na2SO4的质量,溶液中c(Na+)=2c(Na2SO4),溶液是均一的,取出溶液浓度与原溶液浓度相等,根据稀释定律计算稀释后Na2SO4物质的量浓度.
解答 解:Na2SO4的物质的量为0.02L×5mol/L=0.1mol,Na2SO4的质量为0.1mol×142g/mol=14.2g,溶液中c(Na+)=2c(Na2SO4)=2×5mol/L=10mol/L,溶液是均一的,取出溶液浓度与原溶液浓度相等,5mL该溶液中c(SO42-)=c(Na2SO4)=5mol/L,将20mL 5.0mol/L Na2SO4溶液加水稀释至100mL,则稀释后溶液中Na2SO4物质的量浓度为$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:14.2;10;5;1.
点评 本题考查物质的量浓度有关计算,比较基础,注意对定义式理解与灵活应用.

练习册系列答案
相关题目
19.非金属元素H、C、O、S、Cl能形成多种用途很广泛的单质和化合物,试完成下列填空.
(1)O2-的电子式为
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(任选两种)(任写两种)(写化学式,任写两种);
(3)H2O在常温下为液态,H2S为气态,H2O的沸点高于H2S的主要原因是H2O分子之间能形成氢键而H2S不能
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O=SO42-+3H++2Cl-
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)═11:1时,则c(ClO-):c(ClO${\;}_{3}^{-}$)比值等于1:2.
(1)O2-的电子式为

(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(任选两种)(任写两种)(写化学式,任写两种);
(3)H2O在常温下为液态,H2S为气态,H2O的沸点高于H2S的主要原因是H2O分子之间能形成氢键而H2S不能
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)═11:1时,则c(ClO-):c(ClO${\;}_{3}^{-}$)比值等于1:2.
17.三草酸合铁酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0,.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0,.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴适量H2O2,充分振荡后滴加KSCN. |
18.用一定量的MnO2与50mL 10mol/L 盐酸共热制取Cl2,在反应后的溶液中加入足量AgNO3溶液,过滤,洗涤,干燥后得57.4克白色固体则可制得氯气的体积(标准状态)是( )
| A. | 11.2升 | B. | 3.36升 | C. | 2.24升 | D. | 1.12升 |
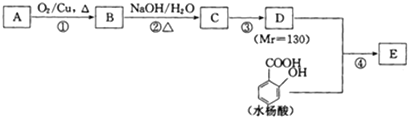

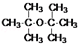 .
.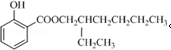 .
.