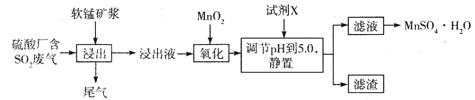
题目内容
(15分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2?12H2O,其工艺流程图如下: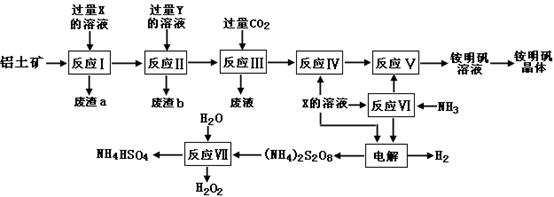
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
(1)二氧化硅(1分)、氢氧化铁(1分)
(2)H2SO4 (1分)
(3)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓(2分);蒸发浓缩(2分)。
(4)2SO42- - 2e-=S2O82-(2分)
(5)(NH4)2S2O8+2H2O=2NH4HSO4+H2O2(2分);
c(H+)>c(SO42-)>c(NH4+)>c(OH-)(2分)
(6) B(2分)
解析试题分析:根据铝土矿的成分和流程图中反应III通入CO2,可推知X为H2SO4,Y为NaOH。
(1)铝土矿加入过量硫酸溶液,得到的废渣a为:二氧化硅;再通入过量的NaOH溶液,Fe2(SO4)3与NaOH反应得到的废渣b为:氢氧化铁。
(2)根据上述分析,流程图中X的化学式为:H2SO4
(3)由工艺流程转化可知,反应III为向含有AlO2-的的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-,反应离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;从铵明矾溶液中获得铵明矾晶体的操作依次为:蒸发浓缩、冷却结晶、过滤洗涤。
(4)根据电解原理阳极失电子发生氧化反应,SO42?失电子生成S2O82-,电极方程式为:2SO42--2e-═S2O82-。
(5)由工艺流程转化可知,反应Ⅶ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4,反应方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2;NH4HSO4溶液中NH4+发生部分水解反应,生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(NH4+)>c(OH-)。
(6)设NH4Al(SO4)2为2mol,溶液中含有2molNH4+、2molAl3+、4molSO42-,Al3+完全沉淀时,需要3molBa(OH)2,此时发生2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓,故C项可能;如SO42-完全反应,则需要4molBa(OH)2,此时发生NH4Al(SO4)2+2Ba(OH)2=NH3?H2O+2BaSO4↓+Al(OH)3↓,故D项可能;如Al3+完全转化为AlO2-,则需要5molBa(OH)2,此时发生2NH4Al(SO4)2+5Ba(OH)2=2NH3?H2O+4BaSO4↓+Ba(AlO2)2+4H2O,则n(NH4Al(SO4)2):n(Ba(OH)2)<2时,生成产物为(NH4)2SO4、BaSO4↓、Al(OH)3,可能含有Al2(SO4)3,故A项可能;n(NH4Al(SO4)2):n(Ba(OH)2) =2时,生成产物为NH3?H2O、BaSO4和Al(OH)3,故B项不可能发生。
考点:本题考查化学流程的分析、基本操作、电解原理、离子浓度比较、化学反应的判断。

 初中暑期衔接系列答案
初中暑期衔接系列答案下列各组离子能大量共存的是
| A.加入KSCN显红色的溶液中:K+、NH4+、Cl―、I― |
| B.含“84”消毒夜(有效成分NaClO)的溶液中:Fe2+、Cl―、Ca2+、Na+ |
| C.常温下,pH=1的溶液中:NH4+、Na+、Cl―、Cu2+ |
| D.常温下,pH=13的无色溶液中:K+、NO3―、HCO3―、Al3+ |
在某无色透明的酸性溶液中,能大量共存的离子组是
| A.Na+ 、K+、SO42-、HCO3- | B.Na十、Ba2+、NO3-、SO42- |
| C.Na+、 K+、Cl-、 NO3- | D.Fe3+、K+、SO42-、OH- |
下表中有关离子方程式的评价合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3·H2O=Al(OH)3¯+3NH4+ | 错误,铝元素的产物应该是AlO2﹣ |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3·H2O+SO2=2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4+ + 2H2O == H3O+ + NH3·H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |