题目内容
下列叙述I和II均正确并有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
B
解析试题分析:A、硝酸钾随温度升高溶解度增大的幅度比氯化钠随温度升高溶解度增大的幅度大,所以当温度降低时,硝酸钾的溶解度骤降,而氯化钠的溶解度变化不大,因此硝酸钾析出,氯化钠留在溶液中,从而除去硝酸钾中的氯化钠,并非是硝酸钾的溶解度大的缘故,错误;B、硫酸钡难溶于酸,先加盐酸无沉淀产生,排除Ag+、CO32-、SO32-的干扰,再加BaCl2溶液有白色沉淀产生,证明原溶液中存在SO42-,正确;C、因为氨气易溶于水,所以可用于设计喷泉实验,与氨气使酚酞溶液变红无因果关系,错误;D、氢氧化钙微溶于水,可配制澄清石灰水,但不能得到浓度为2.0mol/L的Ca(OH)2溶液,错误,答案选B。
考点:考查物质的性质、提纯方法、离子检验的判断

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案稀溶液一般有依数性,即在一定温度下,相同体积的溶液中溶质粒子数目越多,蒸气压下降数值越大。浓度均为0.1 mol·L-1的下列稀溶液,其蒸气压最小的的是
| A.H2SO3溶液 | B.C6H12O6溶液 | C.NaCl溶液 | D.NH3·H2O溶液 |
下表中有关离子方程式的评价合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3·H2O=Al(OH)3¯+3NH4+ | 错误,铝元素的产物应该是AlO2﹣ |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3·H2O+SO2=2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4+ + 2H2O == H3O+ + NH3·H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:__________________________________________________________;
实验②:__________________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 |
| C.Br2>Fe3+ | D.I->Br- |
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
__________________________________________________________________
__________________________________________________________________

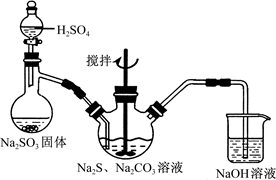
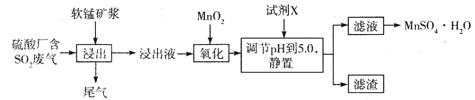

 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、 、
、 、
、 ,已知:
,已知: