题目内容
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是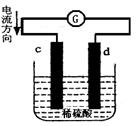
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
B
解析试题分析:在锌片和铜片在稀硫酸中所组成的原电池装置中,由于电流方向是从d到c,所以c是负极,d是正极。A.电池工作的过程中,在正极d电极上H+得到电子变为氢气逸出,因此会产生气泡;所以选项A正确;B.电池工作时,根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中SO42-向正电荷较多的负极c电极移动,错误;C.c为负极,在负极上失去电子,发生氧化反应,正确;D.电池工作的过程中,由于溶液中SO42-没有放电,所以离子的浓度基本不变,正确。
考点:考查铜、锌原电池的工作原理的知识。

练习册系列答案
相关题目
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是( )
| 选项 | X | Y |
| A. | AgNO3 | Cu(NO3)2 |
| B. | MgSO4 | CuSO4 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验: 断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K2,闭合K1一段时间,溶液的pH变大 |
| B.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-====H2↑ |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-====O2↑+2H2O |
| D.断开K1,闭合K2时,OH-向b极移动 |
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
| A.④⑤ | B.③⑤ | C.①② | D.②⑤ |
某小组为研究电化学原理,设计如图装置。下列叙述错误的是
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动 |
| D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色 |
对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法错误的是
| A.溶液中H+向负极移动 | B.电子由Zn经外电路流向Cu |
| C.Zn电极反应:Zn-2e-=Zn2+ | D.Cu是正极 |
锌片和碳棒用导线连接后插入稀硫酸中,锌片是
| A.阴极 | B.正极 | C.阳极 | D.负极 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )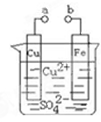
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |