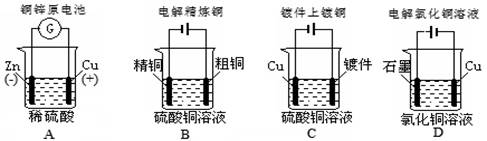
题目内容
有A、B、C三块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极;②A、C相连后,同时浸入稀H2SO4,C极发生氧化反应。则三种金属的活动性顺序为
A.A>C>B B.B>C>A C.C>A>B D.A>B>C
C
解析试题分析:①A、B用导线相连后,同时插入稀H2SO4中,A极为负极;则金属活动性A>B;②A、C相连后,同时浸入稀H2SO4,C极发生氧化反应,则金属活动性C>A.因此三种金属的活动性顺序是C>A>B.因此选项是C。
考点:考查原电池反应在金属活动性顺序比较中的应用的知识。

练习册系列答案
相关题目
在100mLH2SO4和CuSO4的混合液中,用石墨做电极电解,两极上均收集到2.24L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为( )。
| A.1mol?L-1 | B.2mol?L-1 | C.3mol?L-1 | D.4mol?L-1 |
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
| A.放电时Mg2+向正极迁移 |
| B.放电时正极反应为Mo3S4+2xe-===Mo3S42x- |
| C.充电时Mo3S4发生氧化反应 |
| D.充电时阴极反应为Mg2++2e-===Mg |
利用下图装置可以模拟铁的电化学防护。下列说法不正确的是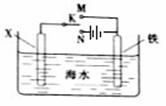
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M处,铁极发生氧化反应 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,X极发生氧化反应 |
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是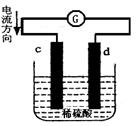
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
下列有关电化学原理的说法错误的是( )
| A.氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
| B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
| C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 |
| D.对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
| A.原混合溶液中c(K+)为1 mol·L-1 | B.上述电解过程中共转移4 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol | D.电解后溶液中c(H+)为2 mol·L-1 |
 I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度