题目内容
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
| A.④⑤ | B.③⑤ | C.①② | D.②⑤ |
D
解析试题分析:把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。Zn是原电池的负极,发生反应:Zn-2e-=Zn2+,发生氧化反应;正极是Cu,在正极上发生反应:2H++2e-=H2↑;所以在正极Cu上有气泡产生,由于H+不断被消耗,发生还原反应;原电池在工作时电子由负极通过电极、导线流向正极,在溶液中阳离子向正极移动,阴离子向负极移动,从而将化学能转变为电能。故该电池的描述合理的是②⑤,选项是D。
考点:考查原电池的工作原理的知识。

Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。
(3)该厂结合本厂实际,选用的X为 (填序号),中和I使溶液中的 (填离子符号)的浓度减小。
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
(5)测定所得Ba(NO3)2晶体的纯度:准确称取m1g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m2g,则该晶体纯度的计算表达式为 。(已知Ba(NO3)2、BaSO4的式量分别为261、233)
如图所示,下列叙述正确的是( ) 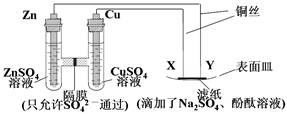
| A.隔膜左侧溶液的质量增加,隔膜右侧溶液的液面升高 |
| B.ZnSO4溶液与CuSO4溶液可以互换 |
| C.X与滤纸接触处有氧气生成 |
| D.Y与滤纸接触处有气泡产生,溶液逐渐变红 |
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
| A.放电时Mg2+向正极迁移 |
| B.放电时正极反应为Mo3S4+2xe-===Mo3S42x- |
| C.充电时Mo3S4发生氧化反应 |
| D.充电时阴极反应为Mg2++2e-===Mg |
下列有关金属铁的腐蚀与防护,说法正确的是
| A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.铁与电源正极连接可实现电化学保护 |
| D.将钢管与铜管一起堆放时可保护钢管少受腐蚀 |
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是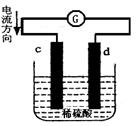
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
| A.电池工作时,电子由正极通过外电路流向负极 |
| B.电池工作时,锌失去电子 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过0.2mol e-,锌的质量理论上减小6.5g |
用石墨做电极电解足量CuSO4溶液。通电一段时间后,欲使用电解液恢复到初始状态,可向溶液中加入适量的
| A.CuSO4 | B.CuO |
| C.H2O | D.CuSO4·5H2O |
