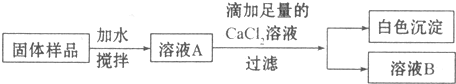
题目内容
2.已知:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| n(CO) | n(H2O) | n(CO2) | n(H2) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
| ③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
| A. | 若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L•min) | |
| B. | 容器③中,开始时υ(CO)生成>υ(CO)消耗 | |
| C. | 达平衡过程体系能量的变化:Q1=4Q2 | |
| D. | 平衡时,①与②容器中CO的体积分数相等 |
分析 A.根据v=$\frac{△c}{△t}$进行计算;
B.容器①②③温度相同,故平衡常数相同,正逆反应平衡常数互为倒数,根据三段式计算出容器①的平衡常数,再根据浓度商与平衡常数的大小关系进行判断;
C.根据平衡常数求出②③中CO2的物质的量变化量;
D.由B、C可知平衡时,容器①②中CO的物质的量.
解答 解:A.平衡时放出的热量为32.8 kJ,故参加反应的CO的物质的量为$\frac{32.8}{41}$=0.8mol,故υ(CO)=$\frac{\frac{0.8mol}{2L}}{10min}$=4.0×10-2 mol/(L•min),故A正确;
B.容器①中,
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):1 4 0 0
变化(mol):0.8 0.8 0.8 0.8
平衡(mol):0.2 3.2 0.8 0.8
故平衡常数k=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.8×0.8}{0.2×3.2}$=1,
故容器③中的平衡常数为1,Qc=$\frac{2×1}{1×1}$=2>1,故平衡逆向移动,故υ(CO)生成>υ(CO)消耗,故B正确;
C.由B可知:容器②中的平衡常数为1,故逆反应的平衡常数也为1,令容器②中CO2的物质的量变化量为amol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol) 1 4 0 0
变化(mol):a a a a
平衡(mol):1-a 4-a a a
平衡常数k=$\frac{a×a}{(1-a)×(4-a)}$=1,解得a=0.8,
令容器③中CO2的物质的量变化量为bmol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 1 1
变化(mol):b b b b
平衡(mol):2-b 1-b 1+b 1+b
平衡常数k=$\frac{(1+b)×(1+b)}{(2-b)×(1-b)}$=1,解得b=0.2,
故容器②中CO2的物质的量变化量为0.8mol,③中CO2的物质的量变化量为0.2mol,故$\frac{{Q}_{1}}{{Q}_{2}}$=$\frac{0.8}{0.2}$=$\frac{4}{1}$,故C正确;
D.由B、C可知:平衡时,容器①中CO的物质的量为0.2mol,容器②中CO的物质的量为0.8mol,故D错误;
故选D.
点评 本题考查化学反应速率及平衡常数的相关计算,难度较大.要注意平衡常数的计算方法及应用.

 阅读快车系列答案
阅读快车系列答案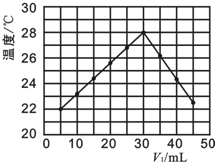 酸碱中和滴定是中学化学中重要的定量实验之一.
酸碱中和滴定是中学化学中重要的定量实验之一.Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
②该苛性钠溶液的浓度为0.080 mol•L-1.
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?答:偏大(填“偏大”、“偏小”或“无影响”).
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL).
(4)下列叙述中正确的是B
A.该实验的环境温度为22℃
B.当V1=40时,溶液中c(Na+)<c(Cl-)
C.NaOH溶液的浓度为1.0mol•L-1
D.保持其他条件不变,只将HCl改为CH3COOH
进行实验,也得到如图的实验结果.
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2=NH4++HSO3- | |
| B. | 在澄清石灰水中通入少量二氧化碳:OH-+CO2=HCO3- | |
| C. | 向溴化亚铁中通入少量氯气:2Br-+Cl2=2Cl-+Br2 | |
| D. | 用氢氧化钠吸收多余的氯气:OH-+Cl2=2Cl-+HClO |
| A. | 过滤时,漏斗下端要紧贴接液烧杯内壁 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干,然后停止加热 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| A. | 15种 | B. | 6种 | C. | 4种 | D. | 2种 |
| A. | 0.10mol•L-1 | B. | 0.15mol•L-1 | C. | 0.225mol•L-1 | D. | 0.30mol•L-1 |

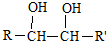 $\stackrel{HIO_{4}}{→}$RCHO+R′CHO
$\stackrel{HIO_{4}}{→}$RCHO+R′CHO . B→H的反应类型是取代反应.
. B→H的反应类型是取代反应.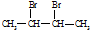 +2NaOH
+2NaOH CH3-C≡C-CH3+2NaBr+2H2O.
CH3-C≡C-CH3+2NaBr+2H2O. .
.