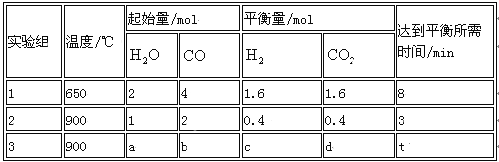
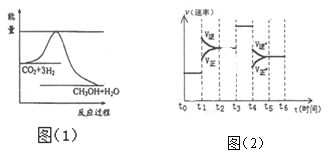
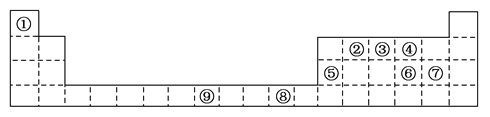
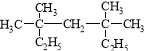题目内容
【题目】常温下,四个容积为20L的容积中分别装有质量相同的下列气体,产生的压强最大的是
A.Cl2 B.CO2 C.SO2 D.HCl
【答案】D
【解析】
试题分析:根据PV=nRT可知,在温度和容积相同的条件下,气体的物质的量越多压强越大。根据n=m/M可知在质量相等时气体的摩尔质量越大,物质的量越小,选项中气体的相对分子质量分别是71、44、64、36.5,所以压强最大的是氯化氢,答案选D。

练习册系列答案
相关题目
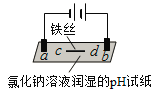
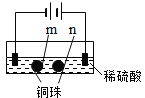
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜