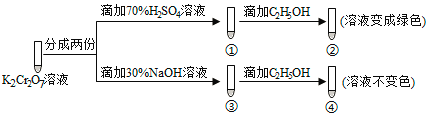
题目内容
【题目】下表为周期表的一部分,其中的编号代表对应不同的元素。
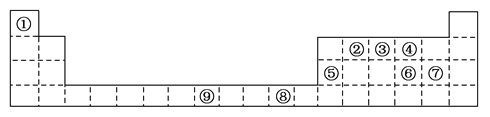
请回答下列问题。
(1)表中属于d区的元素是________(填编号);元素⑧的原子外围电子排布式是________。
(2)③和⑦形成的常见化合物的晶体类型是___ _____;②③④的电负性:________>________>________(用元素符号表示)。判断依据是__________________________,气态氢化物最稳定的是________(写化学式);
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的________(填编号);该元素与元素①形成的化合物X极易溶于水的原因是________________________________。
(4)②⑥形成化合物的化学式为________,其熔点比金刚石的________(填“高”或“低”)。
(5)⑤的氧化物与⑥的最高价氧化物的水化物反应的方程式为_____________________________。
【答案】(1)⑨ 3d104s1
(2)分子晶体 O N C 同周期元素从左到右的非金属性逐渐增强 H2O
(3)③ 氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键
(4)CS2低 (5)Al2O3+3H2SO4===Al2(SO4)3+3H2O
【解析】试题分析:根据元素周期表的结构,①到⑨号元素分别为H、C、N、O、Al、S、Cl、Cu、Fe。
(1)根据元素周期表的结构可知,表中属于d区的元素是⑨;元素⑧是29号元素铜,铜原子的外围电子排布式是3d104s1。
(2)③和⑦形成的常见化合物是NCl3,NCl3熔沸点较低,属于分子晶体;②③④分别为C、N、O,同周期元素,从左到右,元素的电负性逐渐增大,则它们的电负性:O>N>C,判断依据是同周期元素从左到右的非金属性逐渐增强,非金属性越强,气态氢化物越稳定,则气态氢化物最稳定的是H2O。
(3)因为s轨道只能填充2个电子,所以某元素的特征电子排布式为nsnnpn+1,该元素的价电子排布式为2s22p3,位于周期表的第2周期,第ⅤA族,即周期表中的③;N与元素H形成的化合物X为NH3,因为氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键,所以氨气极易溶于水。
(4)②⑥形成化合物是二硫化碳,二硫化碳的化学式为CS2,CS2属于分子晶体,金属石属于原子晶体,所以二硫化碳的熔点比金刚石的低。
(5)⑤的氧化物为Al2O3,⑥的最高价氧化物的水化物为H2SO4,氧化铝属于两性氧化物,能与硫酸反应生成硫酸铝和水,反应的方程式为Al2O3+3H2SO4===Al2(SO4)3+3H2O。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | Fe腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
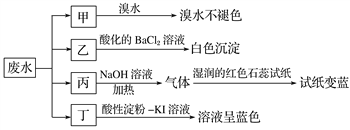
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。