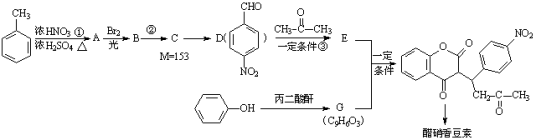
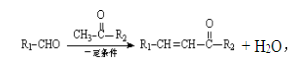
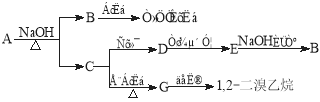
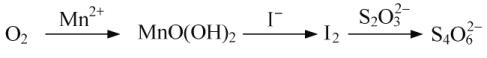题目内容
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为:
![]()
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是_______ (填字母)。
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 mol H-O键
c.υ正(CO)=υ逆(H2)
d.c (CO) = c (H2) e、υ(H2O):υ(CO):υ(H2)=1:1:1
(2) 将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2 (g)+H2 (g) ,得到如下三组数据:
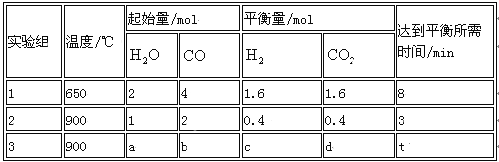
① 实验1中从开始到达平衡时CO表示反应的平均速率为 mol/(l·min),CO(g)的转化率为 。
② 实验2中H2O(g)的转化率为 ,该反应的逆反应为_______ (填“吸”或“放”)热反应。
③ 若实验3平衡时要达到与实验2中平衡时各物质的质量分数分别相等,且t<3min,则a、b应满足的关系 是______________ (用含a、b的数学式表示)。
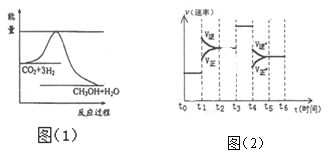
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2 (g)+3H2 (g) CH3OH(g)+H2O(g)图(1)表示该反应进行过程中能量(单位为kJmol-1。)的变化。
① 在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是_______ (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3 molH2
② 当反应达到平衡时不断改变一个条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图(2): 其中表示平衡混合物中CH3OH含量最高的一段时间是_______ ;t1~t2改变的条件为 若t0~t1平衡常数为K1, t2~t3平衡常数为K2 ,则K1 _______K2 (填“>”、“=”或“<”)。
【答案】
(1)de
(2)①0.15 40℅②40℅ 吸③b=2 a(a﹥1)
(3)①cd②t0 ∽t1、升高温度、﹥
【解析】
试题分析:(1)a.随反应进行的气体的物质的量减小,由于容器体积固定,恒温条件下容器中始终压强不变,说明反应到达平衡, a错误;b.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡, b错误;c.根据反应可知,υ正(CO)=υ逆(H2),说明反应到达平衡,c错误;d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,d正确; e、当υ(H2O):υ(CO):υ(H2)=1:1:1,不能说明正逆反应速率相等,也不能说明浓度不变,不能说明反应到达平衡,e正确;故选de;
(2)① 实验1中从开始到达平衡时CO表示反应的平均速率为v=![]() =
=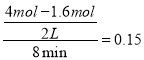 mol/(l·min),CO(g)的转化率为CO的转化率为:
mol/(l·min),CO(g)的转化率为CO的转化率为:![]() ×100%=40%,② 实验2中H2O(g)的转化率为
×100%=40%,② 实验2中H2O(g)的转化率为![]() ,CO的转化率为:
,CO的转化率为:![]() , 则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,逆反应为吸热反应。③使实验3达到平衡状态时各物质的体积分数与实验2分别相等,为等效平衡,到达平衡时间t<3min,说明反应速率加快,该反应为反应前后气体的体积不发生变化,满足n(H2O):n(CO)=1:2即可,且实验3中起始浓度应大于实验2,即b=2 a(a﹥1)。
, 则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,逆反应为吸热反应。③使实验3达到平衡状态时各物质的体积分数与实验2分别相等,为等效平衡,到达平衡时间t<3min,说明反应速率加快,该反应为反应前后气体的体积不发生变化,满足n(H2O):n(CO)=1:2即可,且实验3中起始浓度应大于实验2,即b=2 a(a﹥1)。
(3)①a.由图可知,反应物总能量小于生成物总能量,为放热反应,升高温度平衡逆向移动,c(CH3OH)减小,a错误;b.充入He (g),恒温恒容下,反应各组分浓度不变,平衡不移动,c(CH3OH)不变,b错误;c.将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大,c正确;d.再充入l mol CO2和3molH2,平衡正向移动,c(CH3OH)增大,d正确,故选:cd;
②根据图象知,t1时刻,正逆反应速率都增大且可逆反应向逆反应方向移动,改变的条件是升高温度;t3时刻,正逆反应速率都增大且相等,改变的条件是加入催化剂;t4时刻正逆反应速率都减小,且平衡向逆反应方向移动,改变的条件是减小压强,所以平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,且t0~t1温度小于t2~t3温度,所以K1大于K2,故答案为:t0~t1;升高温度;大于.

【题目】氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得。
(1)氨气的发生装置可以选择下图中的_______,反应的化学方程式为__________________。
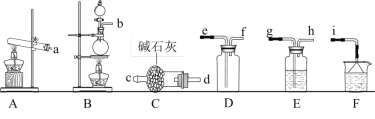
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______(按气流方向,用小写字母表示)。
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如下实验(填写表中空白):
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
(4)小明将滴有酚酞的稀氨水加热,观察到溶液颜色变浅,原因可能是 。
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化。为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①﹥②,则稀盐酸经加热煮沸后浓度 (填“增大”、“减小”或“不变”)。为除去氯化钠溶液中的碳酸钠,小林设计了如下方案:
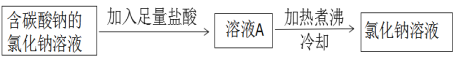
你认为上述方案 (填“合理”或“不合理”),请分析: (如合理,说明原因;如不合理,说明原因并设计改进方案)。
(6)为研究氨气的还原性,小兰做了一下实验:将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
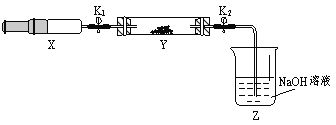
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中___________ | ②反应的化学方程式 ______________________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③___________________ | ④____________________ |
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | Fe腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |