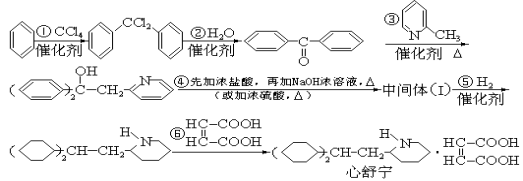
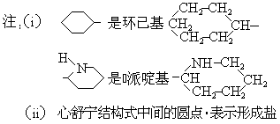
题目内容
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
(2)写出第二次氧化时发生反应的离子方程式。
_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
【答案】(1)碱性;防止生成HCN,造成人员中毒或污染空气。
(2)2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑
(3)14 900
(4)NaOCN、NaCN
【解析】
试题分析:(1)依据HCN的电离平衡常数可知HCN是极弱的酸,所以NaCN极易于酸反应生成HCN。为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性。
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2,首先确定反应物和生成物;再依据反应中氯元素的化合价从+1价降低到-1价,得到2个电子。N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑。
(3)NaCN被氧化的两个阶段氧化剂均为NaClO,所以可以合并一起进行计算,即反应物为NaCN和NaClO,生成物为:Na2CO3、CO2、NaCl和N2。参加反应的NaCN是![]() ,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100m3含NaCN10.3mg/L的废水,实际至少需NaClO的质量为
,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100m3含NaCN10.3mg/L的废水,实际至少需NaClO的质量为![]() g。
g。
(4)(CN)2与Cl2的化学性质相似,则根据氯气与氢氧化钠反应的方程式可知(CN)2与NaOH溶液反应生成NaOCN、NaCN和H2O。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案