题目内容
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
⑴该反应中氧化剂是______________,被氧化的是________元素。
⑵该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为_____________
⑶用双线桥法标出电子转移的方向与数目_________________。
【答案】Cl2或氯气 N或氮 3:2 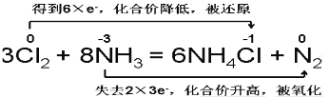
【解析】
(1)8NH3+3Cl2=6NH4Cl+N2,氮元素化合价升高,发生氧化反应,氯元素化合价降低发生还原反应,该反应生成1mol氮气转移6mol电子,据此解答;
(2)该反应中,氯气中的氯元素化合价全部降低,氨气中的氮元素只有![]() 化合价升高,据此解答;
化合价升高,据此解答;
(3)根据得失电子守恒的原理用双线桥法标出电子转移的方向与数目。
(1)该反应氨气中的氯气中的氯元素化合价降低,所以氯气是氧化剂;氮元素化合价升高,被氧化;
(2)在反应8NH3+3Cl2=6NH4Cl+N2,3mol氯气中的氯元素化合价都降低,所以3mol氯气都做氧化剂;8mol氨气中只有2mol氨气中的氮元素化合价升高,所以做还原剂的氨气只有2mol,所以氧化剂和还原剂物质的量之比是3:2;
(3)反应8NH3+3Cl2=6NH4Cl+N2中电子转移的方向和数目用双线桥法表示为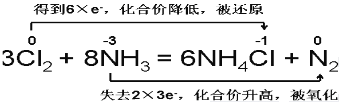 。
。

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目