题目内容
15.N和B元素在化学中占有很重要的地位.(1)写出N元素基态原子的价电子排布式2s22p3.B、N和O元素的电负性由大到小的顺序为O>N>B.
(2)N和B两元素氟化物的化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是N原子和B原子采用不同的杂化方式,其中BF3的分子构型为平面三角形.
(3)BN的晶体结构与金刚石相似其中B原子的杂化方式为sp3,微粒间存在的作用力是共价键.
(4)根据电子云的重叠方式判断,N2分子中存在的σ键和π键数目之比为1:2.
分析 (1)N元素属于第VA族元素,其最外层s能级、p能级上分别含有2、3个电子,根据构造原理书写价电子排布式;同一周期元素中,元素的电负性随着原子序数的增大而增大;
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但N元素的氟化物中氮原子含有孤电子对,B元素的氟化物中B元素不含孤电子对,导致其空间构型不同;根据价层电子对互斥理论确定BF3的分子空间构型;
(3)BN的硬度较大,所以BN是原子晶体,根据金刚石的结构确定BN中B原子的杂化方式;原子晶体中含有共价键;
(4)共价单键为σ,共价三键中含有一个σ键和2个π键.
解答 解:(1)N元素属于第VA族元素,其最外层s能级、p能级上分别含有2、3个电子,根据构造原理知其价电子排布式:2s22p3,
同一周期元素中,元素的电负性随着原子序数的增大而增大,所以三种元素的电负性由大到小的顺序为O>N>B,
故答案为:2s22p3;O>N>B;
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但N元素的氟化物中氮原子含有孤电子对,B元素的氟化物中B元素不含孤电子对,所以N原子和B原子采用的杂化方式不同,导致其空间构型不同;BF3中B原子含有3个σ键且不含孤电子对,所以BF3为平面三角形构型,
故答案为:N原子和B原子采用不同的杂化方式;平面三角形;
(3)BN的硬度较大,所以BN是原子晶体,根据金刚石的结构知BN中B原子的杂化方式为sp3,原子晶体中只含有共价键,故答案为:sp3;共价键;
(4)共价单键为σ,共价三键中含有一个σ键和2个π键,氮气分子的结构式为N≡N,所以一个氮气分子中含有1个σ键和2个π键,则N2分子中存在的σ键和π键数目之比为1:2,故答案为:1:2.
点评 本题考查较综合,涉及化学键的判断、核外电子排布式的书写、化学式的确定等知识点,会利用知识迁移的方法分析BN中B原子杂化方式,难度中等.

| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
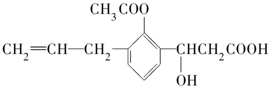 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )①烯烃 ②多官能团有机化合物
③芳香烃 ④烃的衍生物.
| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①③ |
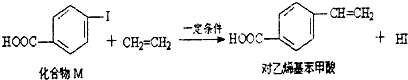
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
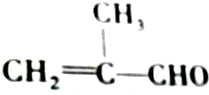 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )| A. | 既能发生氧化反应,又能发生还原反应 | |
| B. | 1 mol该物质只能与1 mol Br2发生加成反应 | |
| C. | 能发生加聚反应 | |
| D. | 能将新制的Cu(OH)2氧化 |
| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: .
.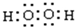 .
.