ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩNi‘ΣΥΊ‘Ύ…ζ≤ζΓΔ…ζΜν÷–”–Ή≈ΙψΖΚΒΡ”Π”ΟΓΘ ΜΊ¥πœ¬Ν–Έ Χβ:
Θ®1Θ©ΜυΧ§Ni‘≠Ή”Φέ≤ψΒγΉ”ΒΡ≈≈≤Φ ΫΈΣΓΓ____ΓΘ
Θ®2Θ©ΩΤ―ßΦ“‘Ύ―–ΨΩΫπ τΩσΈο÷ ΉιΖ÷ΒΡΙΐ≥Χ÷–,ΖΔœ÷ΝΥCu-Ni-FeΒ»Εύ÷÷Ϋπ τΜΞΜ·ΈοΓΘ»ΖΕ®Ρ≥÷÷Ϋπ τΜΞΜ·Έο «ΨßΧεΜΙ «Ζ«ΨßΧεΉνΩ…ΩΩΒΡΩΤ―ßΖΫΖ® «Ε‘ΙΧΧεΫχ––_____ΓΘ
Θ®3Θ©NiΡή”κάύ¬±ΥΊ(SCN)2Ζ¥”Π…ζ≥…Ni(SCN)2ΓΘNi(SCN)2÷–,ΒΎ“ΜΒγάκΡήΉν¥σΒΡ‘ΣΥΊ «____;(SCN)2Ζ÷Ή”÷–,Νρ‘≠Ή”ΒΡ‘”Μ·ΖΫ Ϋ «____ ,Π“ΦϋΚΆΠ–Φϋ ΐΡΩ÷°±»ΈΣ_____ΓΘ
Θ®4Θ©[Ni(NH3)6](NO3)2÷–,≤Μ¥φ‘ΎΒΡΜ·―ßΦϋΈΣ____ (Χν±ξΚ≈)ΓΘ
a.άκΉ”ΦϋΓΓ b.Ϋπ τΦϋΓΓ c.≈δΈΜΦϋΓΓ d.«βΦϋ
Θ®5Θ©ΡχΚœΫπ¥Δ«βΒΡ―–ΨΩ“―»ΓΒΟΚή¥σΫχ’ΙΓΘ
ΔΌΆΦΦΉ «“Μ÷÷ΡχΜυΚœΫπ¥Δ«βΚσΒΡΨßΑϊΫαΙΙ Ψ“βΆΦΓΘ ΗΟΚœΫπ¥Δ«βΚσ,Κ§1molLaΒΡΚœΫπΩ…ΈϋΗΫH2ΒΡ ΐΡΩΈΣ_____ΓΘ
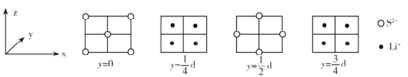
ΔΎMg2NiH4 «“Μ÷÷÷ϋ«βΒΡΫπ τ«βΜ·ΈοΓΘ‘ΎMg2NiH4ΨßΑϊ÷–Θ§Ni‘≠Ή”’ΦΨί»γΆΦ““ΒΡΕΞΒψΚΆΟφ–ΡΘ§Mg2+ ¥Π”Ύ““ΆΦΑΥΗω–ΓΝΔΖΫΧεΒΡΧε–ΡΓΘMg2+ΈΜ”ΎNi‘≠Ή”–Έ≥…ΒΡΓΓ___ (ΧνΓΑΑΥΟφΧεΩ’œΕΓ±ΜρΓΑΥΡΟφΧεΩ’œΕΓ±)ΓΘ »τΨßΧεΒΡΟήΕ»ΈΣdg/cm3Θ§Mg2NiH4ΒΡΡΠΕϊ÷ ΝΩΈΣMg/molΘ§‘ρMg2+ΚΆNi‘≠Ή”ΒΡΉνΕΧΨύάκΈΣΓΓ___ nm(”ΟΚ§dΓΔMΓΔNA ΒΡ¥ζ ΐ Ϋ±μ Ψ)ΓΘ
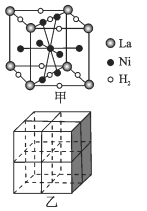
ΓΨ¥πΑΗΓΩ3d84s2 X…δœΏ―ή…δ Β―ι N sp3‘”Μ· 5ΘΚ4 b 3NA ΥΡΟφΧεΩ’œΕ ![]()
ΓΨΫβΈωΓΩ
Θ®1Θ©NiΒΡ‘≠Ή”–ρ ΐΈΣ28Θ§ΗυΨίΡήΝΩΉνΒΆ‘≠άμΩ…–¥≥ωΒγΉ”≈≈≤Φ ΫΈΣ1S22S22P63S23P63d84s2Μρ[Ar]3d84s2Θ§‘ρΤδΦέΒγΉ”≈≈≤ΦΈΣ3d84s2ΘΜ
Θ®2Θ©»ΖΕ®Ρ≥÷÷Ϋπ τΜΞΜ·Έο «ΨßΧεΜΙ «Ζ«ΨßΧεΒΡΖΫΖ® «X…δœΏ―ή…δ Β―ιΘΜ
Θ®3Θ©“ΜΑψ«ιΩωœ¬Θ§Ζ«Ϋπ τ–‘‘Ϋ«ΩΘ§ΒΎ“ΜΒγάκΡή‘Ϋ¥σΘ§ΒΪN‘≠Ή”ΉνΈΣ≤ψ2pΙλΒάΈΣΑκ¬ζΈ»Ε®Ή¥Χ§Θ§ΒΎ“ΜΒγάκΡήΗΏ”ΎœύΝ§‘ΣΥΊΘ§Υυ“‘Ni(SCN)2÷–Θ§ΒΎ“ΜΒγάκΡήΉν¥σΒΡ‘ΣΥΊ «NΘΜΘ®SCNΘ©2Ζ÷Ή”ΫαΙΙΦρ ΫΈΣNΓ‘C-S-S-CΓ‘NΘ§Τδ÷–S‘≠Ή”Φέ≤ψΒγΉ”Ε‘Ηω ΐ «4«“Κ§”–2ΗωΙ¬ΒγΉ”Ε‘Θ§ΗυΨίΦέ≤ψΒγΉ”Ε‘ΜΞ≥βάμ¬έΩ…÷ΣΝρ‘≠Ή”ΒΡ‘”Μ·ΖΫ ΫΈΣsp3‘”Μ·ΘΜΙ≤ΦέΒΞΦϋΈΣΠ“ΦϋΘ§Ι≤ΦέΥΪΦϋ÷–Κ§”–“ΜΗωΠ“ΦϋΓΔ“ΜΗωΠ–ΦϋΘ§Ι≤Φέ»ΐΦϋ÷–Κ§”–1ΗωΠ“ΦϋΓΔ2ΗωΠ–ΦϋΘ§‘ρΠ“ΦϋΚΆΠ–Φϋ ΐΡΩ÷°±»ΈΣ5ΘΚ4ΘΜ
Θ®4Θ©[Ni(NH3)6](NO3)2÷–Θ§NH3”κNi2+÷°ΦδΈΣ≈δΈΜΦϋΘΜΑ±ΤχΖ÷Ή”÷°Φδ¥φ‘Ύ«βΦϋΘΜ[Ni(NH3)6]2+”κNO3-÷°ΦδΈΣάκΉ”ΦϋΘ§≤Μ¥φ‘ΎΫπ τΦϋΘ§Ι ―ΓbΘΜ
Θ®5Θ©ΔΌΨßΑϊ÷–La‘≠Ή” ΐΡΩ=8ΓΝ![]() =1ΓΔH2Ζ÷Ή” ΐΡΩ=
=1ΓΔH2Ζ÷Ή” ΐΡΩ=![]() =3Θ§Ι Κ§1molLaΒΡΚœΫπΩ…ΈϋΗΫH2ΒΡΈο÷ ΒΡΝΩΈΣ1molΓΝ3=3molΘ§ ΐΡΩΈΣ3NAΘΜ
=3Θ§Ι Κ§1molLaΒΡΚœΫπΩ…ΈϋΗΫH2ΒΡΈο÷ ΒΡΝΩΈΣ1molΓΝ3=3molΘ§ ΐΡΩΈΣ3NAΘΜ
ΔΎNi‘≠Ή”’ΦΨίΕΞΒψΚΆΟφ–ΡΘ§Mg2+ ¥Π”ΎΑΥΗω–ΓΝΔΖΫΧεΒΡΧε–ΡΘ§Υυ“‘Mg2+ΈΜ”ΎNi‘≠Ή”–Έ≥…ΒΡΥΡΟφΧεΩ’œΕΘΜ
ΗΟΨßΑϊ÷–Ni‘≠Ή”Ηω ΐ=8ΓΝ![]() +6ΓΝ
+6ΓΝ![]() =4ΓΔMg2+Ηω ΐΈΣ8Θ§ΗυΨίΜ·―ß Ϋ÷ΣΘ§H‘≠Ή”Ηω ΐΈΣ16Θ§Υυ“‘ΨßΑϊΒΡ÷ ΝΩΈΣ
=4ΓΔMg2+Ηω ΐΈΣ8Θ§ΗυΨίΜ·―ß Ϋ÷ΣΘ§H‘≠Ή”Ηω ΐΈΣ16Θ§Υυ“‘ΨßΑϊΒΡ÷ ΝΩΈΣ![]() Θ§”÷“―÷ΣΨßΑϊΒΡΟήΕ»ΈΣdg/cm3Θ§‘ρΨßΑϊΒΡάβ≥ΛΈΣ
Θ§”÷“―÷ΣΨßΑϊΒΡΟήΕ»ΈΣdg/cm3Θ§‘ρΨßΑϊΒΡάβ≥ΛΈΣ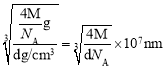 Θ§ΗυΨίΨßΑϊΫαΙΙΩ…÷ΣMg2+ΚΆNi‘≠Ή”ΒΡΉνΕΧΨύάκΈΣΨßΑϊΧεΕ‘Ϋ«œΏΒΡ
Θ§ΗυΨίΨßΑϊΫαΙΙΩ…÷ΣMg2+ΚΆNi‘≠Ή”ΒΡΉνΕΧΨύάκΈΣΨßΑϊΧεΕ‘Ϋ«œΏΒΡ![]() Θ§Υυ“‘ΉνΕΧΨύάκΈΣ
Θ§Υυ“‘ΉνΕΧΨύάκΈΣ![]() ΓΘ
ΓΘ

ΓΨΧβΡΩΓΩI.50 mL 1.0molΓΛLΘ≠1―ΈΥαΗζ50 mL 1.1 molΓΛLΘ≠1«β―θΜ·ΡΤ»ή“Κ‘ΎΆΦΥυ ΨΉΑ÷Ο÷–Ϋχ––÷–ΚΆΖ¥”ΠΘ§≤ΔΆ®Ιΐ≤βΕ®Ζ¥”ΠΙΐ≥Χ÷–ΥυΖ≈≥ωΒΡ»»ΝΩά¥ΦΤΥψ÷–ΚΆ»»ΓΘ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
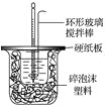
Θ®1Θ©__Θ®ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±Θ©ΫΪΜΖ–Έ≤ΘΝßΫΝΑηΑτΗΡΈΣΜΖ–ΈΫπ τΘ®»γΆ≠Θ©ΑτΓΘ
Θ®2Θ©¥σ…’±≠…œ»γ≤ΜΗ«”≤÷ΫΑεΘ§Ε‘«σΒΟ÷–ΚΆ»» ΐ÷ΒΒΡ”Αœλ «__Θ®ΧνΓΑΤΪΗΏΓ±ΓΑΤΪΒΆΓ±ΜρΓΑΈό”ΑœλΓ±Θ©ΓΘ
Θ®3Θ©»γΙϊΗΡ”Ο60 mL 1.0 molΓΛLΘ≠1―ΈΥαΗζ50 mL 1.1 molΓΛLΘ≠1«β―θΜ·ΡΤ»ή“ΚΫχ––Ζ¥”ΠΘ§‘ρ”κ…œ ω Β―ιœύ±»Θ§ΥυΖ≈»»ΝΩ__Θ®ΧνΓΑ‘ωΦ”Γ±ΓΑΦθ…ΌΓ±ΜρΓΑ≤Μ±δΓ±Θ©ΘΜΥυ«σ÷–ΚΆ»» ΐ÷Β__Θ®ΧνΓΑ‘ωΦ”Γ±ΓΑΦθ…ΌΓ±ΜρΓΑ≤Μ±δΓ±Θ©ΓΘ
Θ®4Θ©__Θ®ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±Θ©”ΟBaΘ®OHΘ©2ΚΆΝρΥα¥ζΧφ―ΈΥαΚΆ«β―θΜ·ΡΤ»ή“ΚΓΘ
Θ®5Θ©Q=cmΠΛtΘ§Τδ÷–Q±μ Ψ¥Υ÷–ΚΆΖ¥”ΠΖ≈≥ωΒΡ»»ΝΩΘ§m±μ ΨΖ¥”ΠΚσΜλΚœ“ΚΒΡ÷ ΝΩΘ§c±μ ΨΖ¥”ΠΚσΜλΚœ»ή“ΚΒΡ±»»»»ίΘ§ΠΛt±μ ΨΖ¥”Π«ΑΚσ»ή“ΚΒΡΈ¬Ε»ΒΡ≤ν÷ΒΓΘΗΟ Β―ι–ΓΉιΉωΝΥ»ΐ¥Έ Β―ιΘ§ΟΩ¥Έ»Γ»ή“ΚΗς50 mLΘ§≤ΔΦ«¬Φ»γœ¬‘≠ Φ ΐΨίΘΚ
Β―ι–ρΚ≈ | Τπ ΦΈ¬Ε»t1/Γφ | ÷’÷ΙΈ¬Ε»t2/Γφ | Έ¬≤νΘ®t2Θ≠t1Θ©/Γφ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
“―÷Σ―ΈΥαΓΔNaOH»ή“ΚΟήΕ»ΫϋΥΤΈΣ1.00 gΓΛcmΘ≠3Θ§÷–ΚΆΚσΜλΚœ“ΚΒΡ±»»»»ίc=4.18410©¹3kJΓΛgΘ≠1ΓΛΓφΘ≠1‘ρΗΟΖ¥”ΠΒΡ÷–ΚΆ»»ΈΣΠΛH=__Θ®±ΘΝτ–Γ ΐΒψΚσ“ΜΈΜΘ©ΓΘ
Θ®6Θ©…œ ω Β―ι ΐ÷ΒΫαΙϊ”κ57.3 kJΓΛmolΘ≠1”–ΤΪ≤νΘ§≤ζ…ζΤΪ≤νΒΡ‘≠“ρΩ…Ρή «__Θ®ΧνΉ÷ΡΗΘ©ΓΘ
aΘ° Β―ιΉΑ÷Ο±ΘΈ¬ΓΔΗτ»»–ßΙϊ≤ν
bΘ°ΝΩ»ΓNaOH»ή“ΚΒΡΧεΜΐ ±―ω ”ΕΝ ΐ
cΘ°Ζ÷Εύ¥ΈΑ―NaOH»ή“ΚΒΙ»κ Δ”–―ΈΥαΒΡ–Γ…’±≠÷–
dΘ°”ΟΈ¬Ε»ΦΤ≤βΕ®NaOH»ή“ΚΤπ ΦΈ¬Ε»Κσ÷±Ϋ”≤βΕ®HCl»ή“ΚΒΡΈ¬Ε»
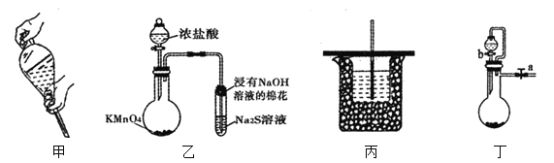
II. ≤ίΥα”κΗΏΟΧΥαΦΊ‘ΎΥα–‘ΧθΦΰœ¬ΡήΙΜΖΔ…ζΖ¥”ΠΘΚ
œ÷”Ο 0.1 mol/L KMnO4Υα–‘»ή“Κ”κ0.5 mol/L H2C2O4»ή“ΚΘ§―–ΨΩ≤ΜΆ§ΧθΦΰΕ‘Μ·―ßΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΓΘ Β―ιΙΐ≥ΧΒΡ ΐΨίΦ«¬Φ»γœ¬(Φϊ±μΗώ)Θ§«κΫαΚœ±μ÷––≈œΔΘ§ΜΊ¥π”–ΙΊΈ ΧβΘΚ
Β―ι –ρΚ≈ | Ζ¥”ΠΈ¬Ε»/Γφ | ≤ΈΦ”Ζ¥”ΠΒΡΈο÷ | |||||
KMnO4Θ®H2SO4Θ© | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/molΓΛLΘ≠1 | V/mL | c/molΓΛLΘ≠1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
Θ®1Θ©–¥≥ωΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____________________ΘΜ
Θ®2Θ©»γΙϊ―–ΨΩ¥ΏΜ·ΦΝΕ‘Μ·―ßΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ§ Ι”Ο Β―ι________ΚΆ________(”ΟAΓΪE±μ ΨΘ§œ¬Ά§)ΘΜ
Θ®3Θ©»γΙϊ―–ΨΩΈ¬Ε»Ε‘Μ·―ßΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ§ Ι”Ο Β―ι________ΚΆ________ΘΜ
Θ®4Θ© Β―ιAΚΆBΘ§Ω…“‘―–ΨΩ≈®Ε»Ε‘Μ·―ßΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ§‘ρV1 =_____ΘΜ
Θ®5Θ©AΓΔBΓΔC»ΐΉι Β―ι±»ΫœΘ§»ή“ΚΆ …ΪΥυ”ΟΒΡ ±ΦδΉν≥ΛΒΡ «__________Ήι Β―ιΓΘ
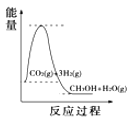
ΓΨΧβΡΩΓΩΡΩ«ΑΙΛ“Β…œΩ…άϊ”ΟCOΜρCO2ά¥…ζ≤ζ»ΦΝœΦΉ¥ΦΘ§Ρ≥―–ΨΩ–ΓΉιΕ‘œ¬Ν–”–ΙΊΦΉ¥Φ÷Τ»ΓΒΡ»ΐΧθΜ·―ßΖ¥”Π‘≠άμΫχ––ΧΫΨΩΓΘ“―÷Σ‘Ύ≤ΜΆ§Έ¬Ε»œ¬ΒΡΜ·―ßΖ¥”ΠΤΫΚβ≥Θ ΐ(K1ΓΔK2ΓΔK3)»γ±μΥυ ΨΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Μ·―ßΖ¥”Π | λ ±δ | ΤΫΚβ≥Θ ΐ | Έ¬Ε»/Γφ | ||
500 | 700 | 800 | |||
ΔΌ2H2(g)ΘΪCO(g) | ΠΛH1 | K1 | 2.5 | 0.34 | 0.15 |
ΔΎCO2(g)ΘΪH2(g) | ΠΛH2 | K2 | 1.0 | 1.70 | 2.52 |
ΔέCO2(g)ΘΪ3H2(g) | ΠΛH3 | K3 | |||
Θ®1Θ©Ζ¥”ΠΔΎ «____(ΧνΓΑΈϋ»»Γ±ΜρΓΑΖ≈»»Γ±)Ζ¥”ΠΓΘ
Θ®2Θ©ΗυΨίΖ¥”ΠΔΌ”κΔΎΩ…ΆΤΒΦ≥ωK1ΓΔK2”κK3÷°ΦδΒΡΙΊœΒΘ§‘ρK3=____(”ΟK1ΓΔK2±μ Ψ)ΘΜΗυΨίΖ¥”ΠΔέ≈–ΕœΠΛS___0(ΧνΓΑΘΨΓ±ΓΔΓΑΘΫΓ±ΜρΓΑΘΦΓ±)Θ§‘Ύ____(ΧνΓΑΫœΗΏΓ±ΜρΓΑΫœΒΆΓ±)Έ¬Ε»œ¬”–άϊ”ΎΗΟΖ¥”ΠΉ‘ΖΔΫχ––ΓΘ
Θ®3Θ©500Γφ ±Θ§≤βΒΟΖ¥”ΠΔέ‘ΎΡ≥ ±ΩΧΘ§CO2(g)ΓΔH2(g)ΓΔCH3OH(g)ΓΔH2O(g)ΒΡ≈®Ε»Ζ÷±πΈΣ0.1mol/LΓΔ0.8mol/LΓΔ0.3mol/LΓΔ0.15mol/LΘ§‘ρ¥Υ ±v(’ΐ)___v(Ρφ)(ΧνΓΑΘΨΓ±ΓΔΓΑ=Γ±ΜρΓΑΘΦΓ±)ΓΘ
Θ®4Θ©ΗυΨί…œ ω±μΗώ≤βΒΟλ ±δΘ§œ¬Ν–ΡήΝΩΙΊœΒΆΦΚœάμΒΡ «_____
A. B.
B.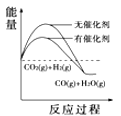 C.
C.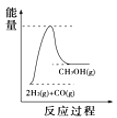 D.
D.