题目内容
【题目】常温下,用0.1molL﹣1的CH3COOH溶液滴定20mL 0.1molL﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
A.Ka=![]() B.V=
B.V=![]()
C.Ka=![]() D.Ka=
D.Ka=![]()
【答案】A
【解析】
试题分析:当滴加VmLCH3COOH溶液时,混合溶液的pH=7,此时溶液中c(OH﹣)=c(H+)=10﹣7mol/L,由电荷守恒c(Na+)=c(CH3COO﹣)=![]() mol/L,根据物料守恒c(CH3COO﹣)+c(CH3COOH)=
mol/L,根据物料守恒c(CH3COO﹣)+c(CH3COOH)=![]() mol/L,联立计算c(CH3COOH),CH3COOH的电离平衡常数为Ka=
mol/L,联立计算c(CH3COOH),CH3COOH的电离平衡常数为Ka=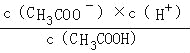 ,代入Ka表达式进行计算.
,代入Ka表达式进行计算.
解:当滴加VmLCH3COOH溶液时,混合溶液的pH=7,此时溶液中c(OH﹣)=c(H+)=10﹣7mol/L,
由电荷守恒:c(OH﹣)+c(CH3COO﹣)=c(H+)+c(Na+),可知c(Na+)=c(CH3COO﹣)=![]() =
=![]() mol/L,
mol/L,
根据物料守恒c(CH3COO﹣)+c(CH3COOH)=![]() mol/L,则c(CH3COOH)=(
mol/L,则c(CH3COOH)=(![]() ﹣
﹣![]() )mol/L=
)mol/L=![]() mol/L,
mol/L,
CH3COOH的电离平衡常数为Ka= =
= =
=![]() ,则V=
,则V=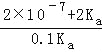 ,
,

练习册系列答案
相关题目