题目内容
13.将6g 铁粉加入200mL Fe2(SO4)3和H2SO4的混合溶液中,充分反应得到200mL A0.5mol/L FeSO4溶液和0.896L的气体.试计算:(1)反应消耗铁的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度.
分析 因氧化性Fe3+>H+,则加入铁粉,先发生Fe+Fe2 (SO4)3=3FeSO4,0.896L的气体是氢气,则后发生Fe+H2SO4=FeSO4+H2↑,然后根据化学反应方程式即可计算.
解答 解:溶液中含有Fe2+:0.5mol•L-1×0.2L=0.1mol<$\frac{6g}{56g/mol}$,
∴6g铁粉过量,设与Fe2(SO4)3反应消耗铁的物质的量为x,生成氢气消耗铁的物质的量为y,
Fe+Fe2 (SO4)3=3FeSO4
1mol 1mol 3mol
xmol xmol 3xmol
Fe+H2SO4 =FeSO4+H2↑,
1mol 1mol 1mol 1mol
ymol ymol ymol ymol
所以$\left\{\begin{array}{l}{3x+y=0.1mol}\\{y=\frac{0.896L}{22.4L/mol}}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{y=0.04}\\{x=0.02}\end{array}\right.$,所以消耗铁为:x+y=0.04+0.02=0.06mol,质量为0.06mol×56g/mol=3.36g,Fe2(SO4)3溶液的物质的量浓度为:$\frac{0.02mol}{0.2L}$=10mol/L,
答:(1)反应消耗铁的质量是3.36g;
(2)原Fe2(SO4)3溶液的物质的量浓度为10mol/L.
点评 本题考查学生利用化学反应方程式的计算,明确氧化性的强弱、反应的先后顺序是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.现有5种基团:-CH3、-OH、-CHO、-COOH、-C6H5,对由其中两两基团构成且显酸性的有关物质叙述正确的是( )
| A. | 共有4种,其中一种物质不属于羧酸 | |
| B. | 共有5种,其中一种为二元酸 | |
| C. | 共有6种,其中只有一种不是有机酸 | |
| D. | 共有6种,它们在一定条件下均能与乙醇发生酯化反应 |
1.某温度下,碳和H2O(g)在密闭容器里发生下列反应:①C(s)+H2O(g)?CO(g)+H2(g),②CO(g)+H2O(g)?CO2(g)+H2(g)当反应达到平衡时,c(H2)=1.9mol•L-1、c(CO)=0.1mol•L-1.则下列叙述正确的是( )
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 其他条件不变时,缩小体积,反应②平衡不移动 | |
| D. | 平衡时增大碳的质量,反应①中热量值不变 |
5.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是( )
| A. | 处理过程中银器一直保持恒重 | |
| B. | 食盐溶液作为电解质溶液形成原电池 | |
| C. | 银器为正极,Ag2S被还原生成单质银 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
2.冶炼金属的方法有多种,冶炼铝选用的方法是( )
| A. | 铝热法 | B. | 电解法 | C. | 热还原法 | D. | 热分解法 |
3.现有乙酸和两种烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
| A. | $\frac{1-a}{7}$ | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$(1-a) | D. | $\frac{12}{13}$(1-a) |
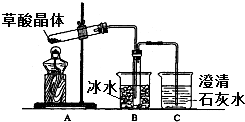 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题: