题目内容
【题目】计算题:(必需写出计算过程)
(1)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L
①求该反应的平衡常数。_____
②在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度。____
(2)利用N2H4(肼)在NO2中燃烧,生成N2、液态H2O,是火箭发射常用的反应之一。已知:N2(g)+2O2(g)=2NO2(g) △H1=+67.2kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol,假如都在相同状态下,请写出发射火箭反应的热化学方程式。(需写出过程)____
【答案】0.25 c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L; 2N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(l) △H=-1135.2kJ/mol
【解析】
根据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到平衡常数的数值;
达到平衡时,测得c(H2)=0.0080mol/L
则 H2 + I2 ![]() 2HI
2HI
起始时各物质的浓度![]() 0.010 0.0100
0.010 0.0100
各物质的浓度变化量![]() 0.00200.00200.0040
0.00200.00200.0040
平衡时各物质的浓度![]() 0.00800.00800.0040
0.00800.00800.0040
(1)该温度下,该反应的平衡常数![]() ;所以该温度下,该反应的平衡常数为0.25,答案:0.25;
;所以该温度下,该反应的平衡常数为0.25,答案:0.25;
(2)在上述温度下该容器中若通入H2和I2蒸气各0.20mol,与上述反应达到相同平衡状态,
则 H2 + I2 ![]() 2HI
2HI![]()
起始时各物质的浓度![]() 0.020 0.020 0
0.020 0.020 0
各物质的浓度变化量![]() x x 2x
x x 2x
平衡时各物质的浓度![]() 0.02-x 0.02-x2X
0.02-x 0.02-x2X
K=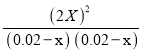 =0.25,解得x=0.004mol/L,所以达到化学平衡状态时各物质的浓度c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;所以本案:c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;
=0.25,解得x=0.004mol/L,所以达到化学平衡状态时各物质的浓度c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;所以本案:c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;
(2)N2(g)+2O2(g) ![]() 2NO2(g) △H=+67.2KJ/mol ①
2NO2(g) △H=+67.2KJ/mol ①
N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) △H=-534KJ/mol ②
N2(g)+2H2O(g) △H=-534KJ/mol ②
由盖斯定律②-①![]() 1/2得到: N2H4(g)+ NO2(g)=3/2N2(g)+4H2O(l) △H=-567.6kJ/mol
1/2得到: N2H4(g)+ NO2(g)=3/2N2(g)+4H2O(l) △H=-567.6kJ/mol
,所以火箭燃烧的热化学反应方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.2kJ/mol;
因此,本题正确答案是: 2N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(l) △H=-1135.2kJ/mol

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案