题目内容
【题目】由一种含钴、铝、锂的电子元件废料(钴以Co2O3·CoO形式吸附在铝箔表面,少量锂混杂其中)回收氧化钴(CoO)的工艺流程如图:
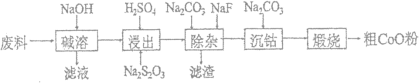
(1)“碱溶”阶段发生的主要反应的离子方程式为___。
(2)“浸出”阶段加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴,得到可溶性硫酸盐,则浸出钴的化学方程式为____。实际工业生产中不用盐酸浸出钴,除了盐酸的挥发性外,更重要的原因是____。
(3)“除杂”阶段将仍残留的微量Al3+、Li+转化为铝锂渣(主要成分是LiF和Al(OH)3),Na2CO3溶液的主要作用是___。
(4)“沉钴”阶段获得碳酸钴需控制溶液pH8~8.5,可能的原因是____。
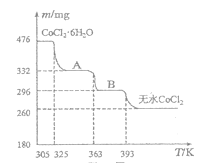
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的示意关系如图,B物质的化学式是___。
【答案】2Al+2OH-+2H2O=2AlO![]() +3H2↑ 4Co2O3CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O 盐酸可能会被氧化产生Cl2,污染环境 调节pH,促进铝离子水解产生氢氧化铝沉淀 pH过低不利于CoCO3沉淀完全,pH过高会产生Co(OH)2沉淀 CoCl2·H2O
+3H2↑ 4Co2O3CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O 盐酸可能会被氧化产生Cl2,污染环境 调节pH,促进铝离子水解产生氢氧化铝沉淀 pH过低不利于CoCO3沉淀完全,pH过高会产生Co(OH)2沉淀 CoCl2·H2O
【解析】
废料中加入氢氧化钠溶液铝转化为偏铝酸钠,将铝从废料中分离出来,过滤后得到含Co2O3·CoO的钴渣,再用硫酸溶解,同时加入硫代硫酸钠还原Co3+,然后加入碳酸钠溶液调节pH利用NaF沉淀Li+,过滤后向滤液中碳酸钠沉钴得到CoCO3沉淀,经过滤洗涤沉淀,最后将CoCO3进行加热分解可得CoO粉末,据此解答。
(1)“碱溶”阶段铝溶解,发生的主要反应的离子方程式为2Al+2OH-+2H2O=2AlO![]() +3H2↑。
+3H2↑。
(2)“浸出”阶段加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴,得到可溶性硫酸盐,反应中硫代硫酸钠是还原剂,+3价钴得到电子,则浸出钴的化学方程式为4Co2O3CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O。实际工业生产中不用盐酸浸出钴,除了盐酸的挥发性外,更重要的原因是盐酸具有还原性,易被氧化为氯气而污染环境。
(3)“除杂”阶段将仍残留的微量Al3+、Li+转化为铝锂渣[主要成分是LiF和Al(OH)3)],因此Na2CO3溶液的主要作用是调节pH,促进铝离子水解产生氢氧化铝沉淀。
(4)由于pH过低不利于CoCO3沉淀完全,pH过高会产生Co(OH)2沉淀,因此“沉钴”阶段获得碳酸钴需控制溶液pH8~8.5。
(5)476mgCoCl2·6H2O的物质的量是0.476g÷238g/mol=0.002mol,其中水的质量是0.216g,根据图像可知固体质量由476mg变为332mg,质量减少144mg,这说明该阶段减少水的物质的量是0.144g÷18g/mol=0.008mol,剩余水的物质的量是0.004mol,质量是0.072g,则A时对应物质的化学式为CoCl2·2H2O。A到B阶段固体质量减少332mg-296mg=36mg,则剩余水的质量是72mg-36mg=36mg,物质的量是0.002mol,因此B对应物质的化学式是CoCl2·H2O。

【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D