题目内容
14.某校文印室里有两台复印机长期工作着,使用和操作复印机的师傅,时常感到身体有不适的现象.一天,一位学生知道后,查阅了相关资料,了解到复印机工作时易产生臭氧,臭氧浓度过高时,对人体有害.臭氧具有强氧化性,可以使湿润的碘化钾淀粉试纸变蓝,其中臭氧部分转化为氧气.(1)写出并配平发生反应的离子方程式O3+2I-+H2O=2OH-+I2+O2;
(2)该反应的氧化剂是O3,还原产物是OH-;
(3)反应中1mol臭氧得到(填“得到”或“失去”)2mol电子.
分析 (1)臭氧具有强氧化性,能和碘离子反应生成碘和氧气,臭氧中部分O元素化合价由0价变为-2价、碘元素化合价由-1价变为0价,根据转移电子守恒结合原子守恒配平方程式;
(2)在氧化还原反应中得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;
(3)该反应中部分臭氧得电子化合价降低.
解答 解:(1)臭氧具有强氧化性,能和碘离子反应生成碘和氧气,臭氧中部分O元素化合价由0价变为-2价、碘元素化合价由-1价变为0价,同时溶液中还生成氢氧根离子,根据转移电子守恒结合原子守恒配平方程式为O3+2I-+H2O=2OH-+I2+O2,故答案为:O3+2I-+H2O=2OH-+I2+O2;
(2)在氧化还原反应中得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,臭氧中部分O元素化合价由0价变为-2价、碘元素化合价由-1价变为0价,所以O3是氧化剂、还原产物是OH-,
故答案为:O3; OH-;
(3)反应中部分臭氧中O元素化合价在反应中由0价变为-2价,根据方程式知,参加反应的$\frac{1}{3}$臭氧在反应中得电子,如果有1mol臭氧参加反应,得到电子的物质的量=1mol×$\frac{1}{3}$×3×[0-(-2)]=2mol,
故答案为:得到;2.
点评 本题考查氧化还原反应的配平、计算及基本概念,明确元素化合价变化是解本题关键,注意该反应中臭氧只有一部分作氧化剂,题目难度不大.

练习册系列答案
相关题目
5.把过量的CO2气体通入到下列物质的溶液中,不变浑浊的是( )
| A. | Ca(OH)2 | B. |  | C. | NaAlO2 | D. | Na2SiO3 |
2.化学与生活密切相关,下列有关说法正确的是( )
| A. | 沼气和液化石油气都是可再生能源 | |
| B. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| C. | PM 2.5含有的铅、铬、砷等对人体有害的元素均是重金属元素 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白体发生变性 |
19.下列对教材中有关数据的叙述不正确的是( )
| A. | 利用沸点数据可以推测将一些液体混合物分离开来的可能性 | |
| B. | 通过比较溶度积常数(Ksp)与溶液中有关离子浓度幂的乘积--离子积(Qc)的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解 | |
| C. | 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性 | |
| D. | 根据分散质粒子直径的大小,可以判断分散系的类别 |
6.下列说法正确的是( )
| A. | 按系统命名法,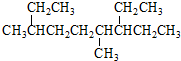 的名称为3,6-二甲基-7-乙基壬烷 的名称为3,6-二甲基-7-乙基壬烷 | |
| B. | 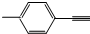 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 标准状况下,1 L辛烷完全燃烧生成CO28L | |
| D. | 1.0 mol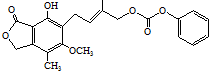 最多能与5.0 mol NaOH水溶液完全反应 最多能与5.0 mol NaOH水溶液完全反应 |
10.下列有关方程式正确的是( )
| A. | 用催化法处理尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| B. | 少量SO2通入到Ba(OH)2溶液:SO2+Ba2++2OH-═BaSO3↓+H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3+OH-═CO32-+H2O | |
| D. | 浓盐酸与二氧化锰供热:Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O |
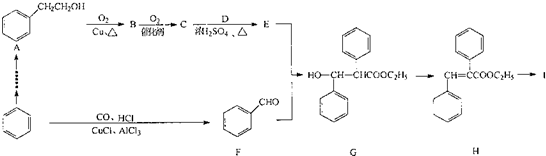
 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.