题目内容
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
(1)Ⅰ、将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式 .
(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: .
(3)Ⅱ、利用如图装置可以验证非金属性的变化规律. 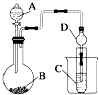
实验室中提供药品浓硫酸、浓盐酸、Na2S、Na2SO3、MnO2、CaCO3,若要证明非金属性Cl>S;装置A、B、C中所装药品分别为 , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 .
(4)若要证明非金属性:S>C>Si,则A中加 , B中加Na2CO3 , C中加 , 则观察装置C中的实验现象为有白色沉淀生成.离子方程式为 .
【答案】
(1)2Al+6H+=2Al3++3H2↑
(2)不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3H2O不是N元素最高价氧化物对应的水化物
(3)浓盐酸、KMnO4、Na2S;S2﹣+Cl2=S↓+2Cl﹣
(4)H2SO4;Na2SiO3;SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣
【解析】解:I、(1)同一周期元素,金属性随着原子序数增大而减弱,元素的金属性越强,同一主族,原子序数越大,金属性越强,其单质与酸或水反应越剧烈,所以金属性K>Na>Mg>Al,则K与盐酸反应最剧烈、Al与盐酸反应速率最慢,离子反应为:2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,可以说明NaOH的碱性大于NH3H2O,但不能说明Na的金属性大于N,因为要验证金属性的强弱,必须通过比较最高价氧化物所对应的水化物的碱性来进行比较,而NH3H2O不是氮元素的最高价氧化物的水化物,
故答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3H2O不是N元素最高价氧化物对应的水化物;II、(3)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为S2﹣+Cl2═S↓+2Cl﹣ , 故答案为:浓盐酸、KMnO4、Na2S;S2﹣+Cl2═S↓+2Cl﹣;(4)若要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明,由于B中加Na2CO3 , 故A中可以加硫酸,通过硫酸和碳酸钠的反应来制取CO2 , 然后的CO2通入C中的Na2SiO3中,可以发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3 , 离子反应为:SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ , 产生白色胶状沉淀,从而可以证明酸性:H2CO3>H2SiO3 , 故非金属性:C>Si.故答案为:H2SO4;Na2SiO3;SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ .
I、(1)元素的金属性越强,其单质与酸或水反应越剧烈;(2)元素的最高价氧化物的水化物的碱性越强,元素的金属性越强;II、(3)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;(4)要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。

①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
(4)实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是 (_____)
(_____)
选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
A | 浓氨水 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
【题目】下列关于物质分类的正确组合为
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | 石灰水 | CH3COOH | CaF2 | SO3 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. A B. B C. C D. D

