题目内容
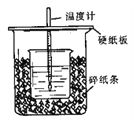
【题目】Ⅰ.(1)指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①_____________________________________;②_______________________________________。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.玻璃棒用作引流 b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:

(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为有色溶液),下层_____色。

Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

(1)欲证明滤液中存在SO42-、OH -,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH - 均存在。
(2)如何洗涤Mg(OH)2沉淀?___________________________________________。
【答案】温度计伸入液面内冷凝水上进下出bd过滤萃取分液D 紫红酚酞盐酸和BaCl2用玻璃棒引流向过滤器中加蒸馏水直至没过沉淀,静置,待液体流出后,重复上述操作2-3次
【解析】
I.(1).温度计水银球应与蒸馏烧瓶支管口相平,冷凝水应下进上出;(2).过滤要遵循“一贴二低三靠”;II. 海藻灼烧浸泡得到海藻灰悬浊液,过滤得到含碘离子的溶液,通入氯气将碘离子氧化为碘单质,得到含碘的水溶液,加入有机萃取剂进行分液萃取得到含碘单质的有机溶液,蒸馏得到晶体碘;III.(1).证明滤液中存在SO42-、OH -,可先加入酚酞,溶液变红可以说明滤液中含有OH -,用盐酸酸化后加入氯化钡溶液,出现白色沉淀,说明滤液中含有SO42-;(2).洗涤沉淀的操作为向漏斗中加蒸馏水至浸没沉淀,待水自然流出后,重复2~3次。
I.(1). ①.进行蒸馏操作时,因温度计是测量馏分的温度,则温度计水银球应该位于蒸馏烧瓶的支管口处,与支管口相平而不能插入液面以下,故答案为:温度计伸入液面内;
②.为了达到更好的冷凝效果,冷凝水应与蒸汽逆流且充满整个冷凝管,所以冷凝水应从下口进水、上口出水,故答案为:冷凝水上进下出;
(2).a.玻璃棒用作引流,使液体顺利流下,故a正确;
b.玻璃棒不能在漏斗中轻轻搅动,因为这样可能会捣破滤纸,过滤失败,故b错误;
c. 将滤纸湿润,使其紧贴漏斗壁,防止液体从滤纸与漏斗的缝隙流下,故c正确;
d.滤纸边缘应低于漏斗上边缘,故d错误,答案为:bd;
II. 海藻灼烧浸泡得到海藻灰悬浊液,过滤得到含碘离子的溶液,通入氯气将碘离子氧化为碘单质,得到含碘的水溶液,加入有机萃取剂进行分液萃取得到含碘单质的有机溶液,蒸馏得到晶体碘。
(1). 过滤适用于不溶于水的固体和液体,根据流程图可知,分离固体海藻灰和液体碘离子的溶液需要用过滤操作,因为碘在有机溶剂中的溶解度比在水中的大,所以用萃取分液可得到含碘的有机溶液,故答案为:过滤;萃取分液;
(2). 碘在四氯化碳中的溶解度大于在水中的溶解度,能将碘水中的碘转移到四氯化碳中,四氯化碳的密度比水大,溶解碘后四氯化碳层为紫红色,所以在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的现象是溶液分层,上层颜色接近无色,下层呈紫红色,故答案为:D;紫红;
III.(1). 欲证明滤液中存在SO42-、OH -,选用的方案是先取少量的滤液滴加酚酞,发现溶液变红,再向其中加入盐酸和BaCl2溶液,出现白色沉淀,则可证明SO42-、OH - 均存在,故答案为:酚酞;盐酸和BaCl2;
(2). 洗涤Mg(OH)2沉淀的方法是:用玻璃棒引流向过滤器中加蒸馏水直至没过沉淀,静置,待液体流出后,重复上述操作2-3次,故答案为:用玻璃棒引流向过滤器中加蒸馏水直至没过沉淀,静置,待液体流出后,重复上述操作2-3次。

【题目】现有6瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖中的一种。现通过如下实验来确定各试剂瓶中所装液体的名称:
实验步骤和方法 | 实验现象 |
①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
②各取少量于试管中 ,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
③分别取少量6种液体于试管中,加新制Cu(OH)2并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(1)写出这6种物质的名称。
A____________ B____________ C____________ D____________ E____________ F____________
(2)在D中加入NaOH溶液并加热的化学方程式为__________________