题目内容
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是________(写化学式)。
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下:
① H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
② CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+ ![]() O2(g) △H=_________kJ/mol。
O2(g) △H=_________kJ/mol。
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。
① 工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为
CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO。下图是变压吸附回收高炉煤气中CO的流程图:
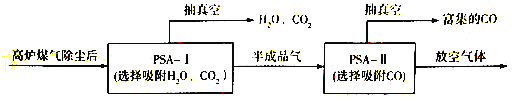
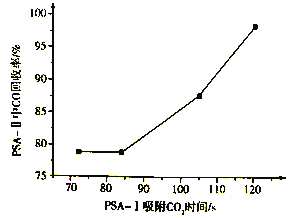
PSA-I吸附CO2时间对PSA-II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是________, “放空气体”的主要成分为_______。
(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+ 3 CO(g)===2Fe (s)+3CO2(g)。该反应在不同温度下的平衡常数如下表所示:
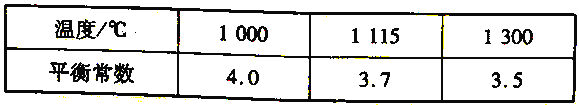
① 该反应的△H______0(填“> " " < ”或“= " )。
② 欲提高上述反应中CO 的转化率,可采取的措施是______。
a.适当降低反应体系的温度 b.及时移出体系中的CO2 c.加入合适的催化剂
d.减小容器的容积 e.增大Fe2O3的量
【答案】 N2、CO +35.7 ①升温、减压 延长PSA -I吸附CO2时间 N2 < ab
【解析】试题分析:(1)N2、CO、CO2、H2O的电子数分别是14、14、22、10;(2)根据盖斯定律计算CO(g)+2H2(g)=CH4(g)+ ![]() O2(g) 的△H;(3)①根据平衡移动原理分析;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO;(4)①升高温度,平衡常数减小,平衡逆向移动;②平衡正向移动,可以提高CO 的转化率;
O2(g) 的△H;(3)①根据平衡移动原理分析;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO;(4)①升高温度,平衡常数减小,平衡逆向移动;②平衡正向移动,可以提高CO 的转化率;
解析:(1)N2、CO、CO2、H2O中N2、CO的电子数相等;
(2)① H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
② CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
根据盖斯定律,①![]() ②
② ![]() ③ 得CO(g)+2H2(g)=CH4(g)+
③ 得CO(g)+2H2(g)=CH4(g)+ ![]() O2(g) △H=+35.7 kJ/mol;(3)①CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0,要分离CO可使平衡逆向移动,如升温、减压等;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大,所以应采取的措施是延长PSA -I吸附CO2时间;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO,所以“放空气体”的主要成分为N2;(4)①升高温度,平衡常数减小,平衡逆向移动,所以正反应放热,△H<0;②a.适当降低反应体系的温度,平衡正向移动,CO 的转化率增大; b.及时移出体系中的CO2,平衡正向移动,CO 的转化率增大; c.加入合适的催化剂,平衡不移动,CO 的转化率不变,故c错误;d.减小容器的容积,平衡不移动,CO 的转化率不变,故d错误; e.Fe2O3是固体,增大Fe2O3的量,平衡不移动,CO 的转化率不变,故e错误。
O2(g) △H=+35.7 kJ/mol;(3)①CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0,要分离CO可使平衡逆向移动,如升温、减压等;②根据图示,PSA -I吸附CO2时间越长,吸附剂对CO的吸附效率越大,所以应采取的措施是延长PSA -I吸附CO2时间;高炉煤气主要成分为N2、CO、CO2、H2O等,PSA-I吸附CO2、H2O,PSA-II吸附CO,所以“放空气体”的主要成分为N2;(4)①升高温度,平衡常数减小,平衡逆向移动,所以正反应放热,△H<0;②a.适当降低反应体系的温度,平衡正向移动,CO 的转化率增大; b.及时移出体系中的CO2,平衡正向移动,CO 的转化率增大; c.加入合适的催化剂,平衡不移动,CO 的转化率不变,故c错误;d.减小容器的容积,平衡不移动,CO 的转化率不变,故d错误; e.Fe2O3是固体,增大Fe2O3的量,平衡不移动,CO 的转化率不变,故e错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
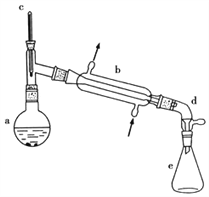
小学生10分钟应用题系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量![]()
Ⅰ![]() 实验步骤
实验步骤
(1)配制100mL待测白醋溶液:用 ______ ![]() 填仪器名称
填仪器名称![]() 量取
量取![]() 市售白醋,在烧杯中用水稀释后转移到 ______
市售白醋,在烧杯中用水稀释后转移到 ______ ![]() 填仪器名称
填仪器名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液![]() 于锥形瓶中,向其中滴加2滴 _____ 作指示剂.
于锥形瓶中,向其中滴加2滴 _____ 作指示剂.
(3)读取盛装![]() NaOH溶液的碱式滴定管的初始读数
NaOH溶液的碱式滴定管的初始读数![]() 如果液面位置如图所
如果液面位置如图所![]() 示,则此时的读数为 ______ mL.
示,则此时的读数为 ______ mL.
(4)滴定![]() 当 ______ 时,停止滴定,并记录NaOH溶液的终读数
当 ______ 时,停止滴定,并记录NaOH溶液的终读数![]() 重复滴定3次.
重复滴定3次.
(5)实验记录
滴定次数实验数据 | 1 | 2 | 3 | 4 |
|
|
|
|
|
|
|
|
|
|
Ⅲ![]() 数据处理与讨论
数据处理与讨论
按实验所得数据,可得![]() 市售白醋
市售白醋![]() ______
______ ![]() ;市售白醋总酸量
;市售白醋总酸量![]() ______
______ ![]() .
.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是 ______ (填写序号![]() .
.
![]() 碱式滴定管在滴定时未用标准NaOH溶液润洗
碱式滴定管在滴定时未用标准NaOH溶液润洗
![]() 碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
![]() 锥形瓶中加入待测白醋溶液后,再加少量水
锥形瓶中加入待测白醋溶液后,再加少量水
![]() 锥形瓶在滴定时剧烈摇动,有少量液体溅出.
锥形瓶在滴定时剧烈摇动,有少量液体溅出.