题目内容
【题目】Ⅰ、用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
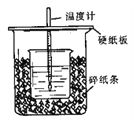
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________。
(2)烧杯间填满碎纸条的作用是________________。
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________________(填“相等、不相等”),所求中和热___________(填“相等、不相等”)。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验, 测得的中和热的数值会________________。(填“偏大”、“偏小”、“无影响”)。
Ⅱ、(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________。

(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=___________。
(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,写出C2H2燃烧的热化学方程式:_______________________________________________。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 不相等 相等 偏小 NO2(g) + CO(g) = CO2(g) + NO(g) △H=-234kJ/mol △H=+226.7 kJ/mol 2C2H2(g)+5O2(g) == 4CO2(g)+2H2O(l) ΔH= -2480 kJ/mol
【解析】试题分析:Ⅰ、(1)根据量热计的构造分析;(2)中和热测定实验成败的关键是防止热量散失;(3)反应放出的热量和所用酸以及碱的量的多少有关;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关。(4)氨水为弱碱,电离过程吸热;Ⅱ、(1)焓变=生成物的总能量-反应物的总能量;(2)根据盖斯定律计算C(s,石墨)和H2(g)生成1mol C2H2(g)的焓变;(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,则2molC2H2完全燃烧生成液态水和CO2,放出2480 kJ热量。
解析:Ⅰ、(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;(2)中和热测定实验成败的关键是防止热量散失,烧杯间填满碎纸条的作用是减少实验过程中的热量损失;(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25molL-1H2SO4溶液跟50mL0.55molL-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量不相等;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以所求中和热数值相等。(4)氨水为弱碱,电离过程吸热,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小;Ⅱ、(1)焓变=生成物的总能量-反应物的总能量,根据图示NO2和CO反应的热化学方程式是NO2(g) + CO(g) = CO2(g) + NO(g) △H=-(368 kJ/mol -134 kJ/mol)=-234kJ/mol;
(2) ①C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律①![]() 2+②
2+②![]() —③
—③ ![]() ,得C(s,石墨)+H2(g)= C2H2(g) △H=+226.7 kJ/mol;(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,则2molC2H2完全燃烧生成液态水和CO2,放出2480 kJ热量,所以C2H2燃烧的热化学方程式是2C2H2(g)+5O2(g) == 4CO2(g)+2H2O(l) ΔH= -2480 kJ/mol。
,得C(s,石墨)+H2(g)= C2H2(g) △H=+226.7 kJ/mol;(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,则2molC2H2完全燃烧生成液态水和CO2,放出2480 kJ热量,所以C2H2燃烧的热化学方程式是2C2H2(g)+5O2(g) == 4CO2(g)+2H2O(l) ΔH= -2480 kJ/mol。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案