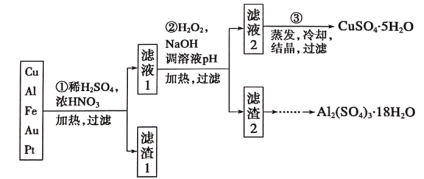
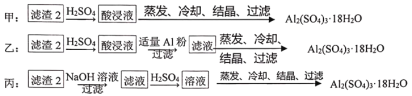
题目内容
【题目】有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
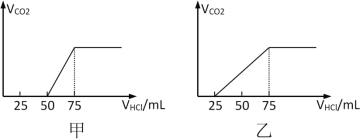
试分析NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是什么?其物质的量之比是多少?__________产生的CO2气体体积(标况)是多少?____________
【答案】NaOH、Na2CO3 1:1;Na2CO3、NaHCO3 1:1; 56mL;112mL
【解析】
当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。
(1)(甲)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(乙)中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3,根据反应消耗盐酸的体积计算NaHCO3、Na2CO3的物质的量之比;
(2)根据碳元素守恒可知,(甲)中从50mL~75mL消耗25mL盐酸时生成的二氧化碳,而(乙)中从25mL~75mL消耗50mL盐酸时生成的二氧化碳,根据方程式进而计算生成二氧化碳的体积。
(1)(甲)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1;(乙)中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3, Na2CO3转化为NaHCO3消耗盐酸体积为25mL,则原溶液中NaHCO3消耗盐酸体积50mL-25mL=25mol,故NaHCO3、Na2CO3的物质的量之比=25mL:25mL=1:1,故答案为:NaOH、Na2CO3,1:1;NaHCO3、Na2CO3,1:1;
(2)根据碳元素守恒可知,(甲)中从50mL~75mL消耗25mL盐酸时生成的二氧化碳,该阶段生成二氧化碳为0.025L×0.1mol·L-1=0.0025mol,体积为0.0025mol×22.4L·mol-1=0.056L=56mL,而(乙)中从25mL~75mL消耗50mL盐酸时生成的二氧化碳,该阶段生成二氧化碳为0.05L×0.1mol·L-1=0.005mol,体积为0.005mol×22.4L·mol-1=0.112L=112mL,故答案为:56;112。

【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。