题目内容
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 四种元素,
四种元素,![]() 元素是地壳中含量最多的金属元素;
元素是地壳中含量最多的金属元素;![]() 元素的原子其
元素的原子其![]() 层(有电子)电子数比
层(有电子)电子数比![]() 层少1;
层少1;![]() 元素的原子得到2个电子和
元素的原子得到2个电子和![]() 元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中![]() 元素的名称是______。
元素的名称是______。
(2)画出![]() 元素原子的结构示意图:____________。
元素原子的结构示意图:____________。
(3)写出下列化学方程式。
①单质![]() 在单质
在单质![]() 中燃烧:__________________;
中燃烧:__________________;
②![]() 的氢氧化物和
的氢氧化物和![]() 的氢氧化物在溶液中反应:________________________。
的氢氧化物在溶液中反应:________________________。
【答案】氧 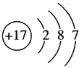
![]()
![]()
【解析】
A、B、C、D四种元素,A元素是地壳中含量最多的金属元素,故A为Al元素;B元素的原子其M层电子数比L层少1个电子,故M层电子数为8-1=7,故B为Cl元素;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构,故C原子核外电子数为10-2=8,为O元素,D元素原子核外电子数为10+1=11,故D为Na元素,据此分析解答。
(1)由上述分析可知,C为氧元素;
(2)B为氯元素,原子序数为17,核内有17个质子,核外电子数为17,有3个电子层,最外层电子数为7,原子结构示意图 ;
;
(3)钠在氧气中燃烧生成过氧化钠,化学方程式为:![]() ;A的氢氧化物为氢氧化铝,D的氢氧化物为氢氧化钠,反应生成偏铝酸钠和水,反应的离子方程式为:
;A的氢氧化物为氢氧化铝,D的氢氧化物为氢氧化钠,反应生成偏铝酸钠和水,反应的离子方程式为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的△H=-163kJ/mol,1molN2(g),1molO2(g)分子中化学键断裂时分别需要吸收945kJ,498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20min时段,反应速率v(N2O)为___molL-1min1。
②若N2O起始浓度c0为0.150 molL-1,则反应至30min时N2O的转化率α=___。比较不同起始浓度时N2O的分解速率:v(c0=0.150molL-1)___v(c0=0.001molL-1)(填“>”、“=”或“<”)。
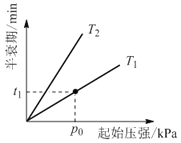
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1____T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) ![]() 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=kc(N2O)[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.N2O分解反应中,k(含碘)>k(无碘)
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2浓度与N2O分解速率无关