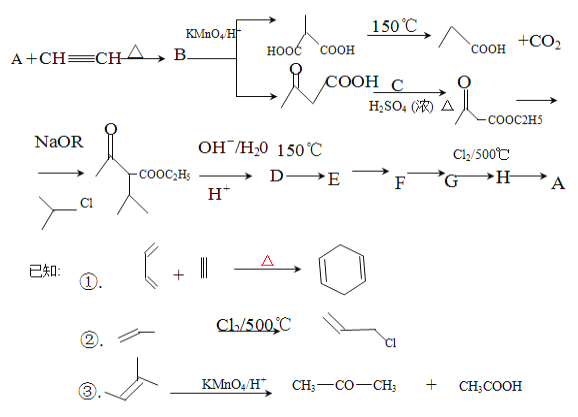
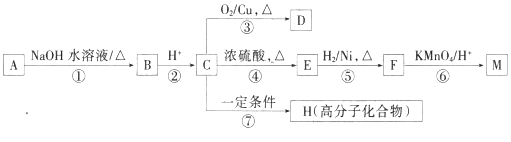
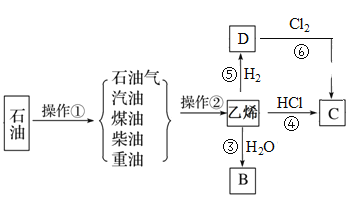
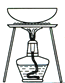
题目内容
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
【答案】C
【解析】
由图可知加入0.4molNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.4mol,加入0.5molNaOH时,沉淀由最大值减小为最小值,故0.1molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.1mol,所以2n[Mg(OH)2]+3×0.1mol=0.4mol,故n[Mg(OH)2]=0.05mol,根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2]=2×0.05mol=0.1mol,根据化学式Al2(SO4)3可知溶液中n(SO42-)=![]() n[Al(OH)3]=
n[Al(OH)3]= ![]() ×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3;
×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3;
故选:C。

练习册系列答案
相关题目
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 除去乙醇中的苯 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.1000mol·L1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. AB. BC. CD. D