题目内容
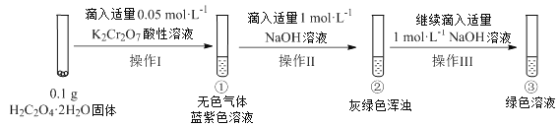
【题目】全钒氧化还原电池是一种新型可充电电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+- e-=V3+,下列说法正确的是
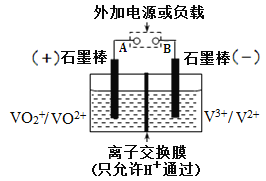
A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
【答案】B
【解析】
该电池放电时,右槽中的电极反应为:V2+-e-=V3+,为被氧化的过程,应为原电池负极反应,则左槽为原电池正极,发生还原反应,电极方程式应为VO2++2H++e-=VO2++H2O,充电时电极反应为放电电极反应的逆反应,以此解答该题。
A.电池放电时,右槽中的电极反应为:V2+-e-=V3+,可知发生氧化反应,故A错误;
B.放电时,左槽发生还原反应,电极方程式应为VO2++2H++e-=VO2++H2O,故B正确;
C.充电时,左槽电极反应式为VO2++H2O-e-=VO2++2H+,每转移1mol电子,n(H+)的变化量为2mol,故C错误;
D.充电时,阴极发生V3++e-=V2+,H+参加反应,pH不发生变化,故D错误。
故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目