��Ŀ����
����ʹ�������Դ����չ����̼���á�����Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1������ˮ����ת������H2����Ҫת����Ӧ���£�
CH4(g) + H2O(g) CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1
CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1
CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1
������Ӧ����ԭ�����е�CO��ʹ�ϳɰ��Ĵ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ���Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��2�������״���ԭ��CO��H2��Դ�ڣ�CH4(g) + H2O(g) CO(g) + 3H2(g) ��H>0
CO(g) + 3H2(g) ��H>0
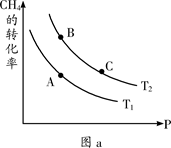
��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ___________��(�<������>������="��" )��
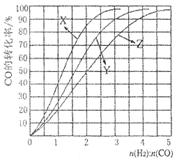
��100��ʱ����1 mol CH4��2 mol H2Oͨ���ݻ�Ϊ1 L�Ķ����ܷ������У�������Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����__________
a�������������ܶȺ㶨
b����λʱ��������0��1 mol CH4ͬʱ����0��3 mol H2
c��������ѹǿ�㶨
d��3v��(CH4) = v��(H2)
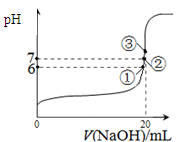
��3��25��ʱ����20mL0��1mol/L������м���VmL0��1mol/LNaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����_____��
A��pH��3��HF��Һ��pH��11��NaF��Һ�У� ��ˮ�������c(H+)���
B���ٵ�ʱpH��6����ʱ��Һ�У�c(F��)��c(Na+)��9��9��10-7mol/L
C���ڵ�ʱ����Һ�е�c(F��)��c(Na+)
D���۵�ʱV��20mL����ʱ��Һ��c(Na+)��0��1mol/L
��4������������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO����ṹʽΪH��O��F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��1������ˮ����ת������H2����Ҫת����Ӧ���£�
CH4(g) + H2O(g)
 CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1
CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1CH4(g) + 2H2O(g)
 CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1
CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1������Ӧ����ԭ�����е�CO��ʹ�ϳɰ��Ĵ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ���Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��2�������״���ԭ��CO��H2��Դ�ڣ�CH4(g) + H2O(g)
 CO(g) + 3H2(g) ��H>0
CO(g) + 3H2(g) ��H>0��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ___________��(�<������>������="��" )��

��100��ʱ����1 mol CH4��2 mol H2Oͨ���ݻ�Ϊ1 L�Ķ����ܷ������У�������Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����__________
a�������������ܶȺ㶨
b����λʱ��������0��1 mol CH4ͬʱ����0��3 mol H2
c��������ѹǿ�㶨
d��3v��(CH4) = v��(H2)
��3��25��ʱ����20mL0��1mol/L������м���VmL0��1mol/LNaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����_____��

A��pH��3��HF��Һ��pH��11��NaF��Һ�У� ��ˮ�������c(H+)���
B���ٵ�ʱpH��6����ʱ��Һ�У�c(F��)��c(Na+)��9��9��10-7mol/L
C���ڵ�ʱ����Һ�е�c(F��)��c(Na+)
D���۵�ʱV��20mL����ʱ��Һ��c(Na+)��0��1mol/L
��4������������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO����ṹʽΪH��O��F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��1�� CO(g) + H2O(g) CO2(g) + H2(g) ��H=��41��2 kJ��mol��1 ��2�֣�
CO2(g) + H2(g) ��H=��41��2 kJ��mol��1 ��2�֣�
��2���� KC = KB >KA ��2�֣�
�� cd ��2�֣�
��3��BC ��2�֣�
��4��H2O��HFO=HF��H2O2 ��2�֣�
 CO2(g) + H2(g) ��H=��41��2 kJ��mol��1 ��2�֣�
CO2(g) + H2(g) ��H=��41��2 kJ��mol��1 ��2�֣���2���� KC = KB >KA ��2�֣�
�� cd ��2�֣�
��3��BC ��2�֣�
��4��H2O��HFO=HF��H2O2 ��2�֣�
�����������1�� �ȶ���֪�Ȼ�ѧ����ʽ���Ϊ�٢ڣ��۲췢�֢�-�ٿɵã�CO(g) + H2O(g)
 CO2(g) + H2(g) ��H=��41��2 kJ��mol��1��
CO2(g) + H2(g) ��H=��41��2 kJ��mol��1����2���� ƽ�ⳣ��ָ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ����ѧƽ�ⳣ��ֻ���¶��йأ�����B��C��������ͬ���¶ȣ�����KC = KB��Ȼ��A��B������ȣ���A��B�������ת���ʱ��˵���������ƶ�����ѧƽ�ⳣ���������KB>KA �����Դ���KC = KB >KA��
�� ��������������ֲ��䣬���������غ㶨��֪����Ӧǰ����������������䣬����������������ܶȲ��䣬���Բ��ܱ����ﵽ��ѧƽ��״̬����a����λʱ��������0��1 mol CH4ͬʱ����0��3 mol H2��������v�������Բ��ܱ����ﵽ��ѧƽ��״̬����b�����淴Ӧ���л�����������ʵ������������ݻ����䣬ѹǿ����������ѹǿ�㶨ʱ��˵������ƽ�⣬��c��ȷ��3v��(CH4) = v��(H2)�����ʵ���������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬��d��ȷ������ѡcd��
��3��pH��3��HF��Һ����ˮ�������c(H+)��
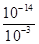 ��10-11mol��L��1��pH��11��NaF��Һ�У���ˮ�������c(H+)��10-14/10-11��10-3mol��L��1��A�����ٵ�ʱ�����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)��c(F��)��c(Na+)��c(H��)��c(OH��)��10-6��
��10-11mol��L��1��pH��11��NaF��Һ�У���ˮ�������c(H+)��10-14/10-11��10-3mol��L��1��A�����ٵ�ʱ�����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)��c(F��)��c(Na+)��c(H��)��c(OH��)��10-6��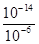 ��9��9��10-7mol/L��B�ԣ����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)���ڵ�ʱpH=7����Һ�е�c(H��)��c(OH��)������c(F��)��c(Na+)��C�ԣ��۵�ʱV��20mL����ʱ��Һ��c(Na+)��
��9��9��10-7mol/L��B�ԣ����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)���ڵ�ʱpH=7����Һ�е�c(H��)��c(OH��)������c(F��)��c(Na+)��C�ԣ��۵�ʱV��20mL����ʱ��Һ��c(Na+)��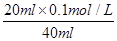 ��0��05mol/L������ѡBC��
��0��05mol/L������ѡBC����4���縺��F��O����H-O-F��FԪ�ر���-1�ۣ���ˮ��Ӧ����HF������ˮ�ⷴӦ������֪AΪH-O-O-H���÷�Ӧ�Ļ�ѧ����ʽΪ��H2O+HFO=HF+H2O2��

��ϰ��ϵ�д�
 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
�����Ŀ
 CO2(g) + H2(g)����Ӧ�����и����ʵ�Ũ������ͼt1ǰ��ʾ�仯���������¶Ȳ��䣬t2ʱ���������г���CO��H2��1mol��ƽ�⽫ �ƶ�������� �����ҡ���������t2ʱ�����ı䷴Ӧ����������H2Ũ�ȷ�������ͼt2����ʾ�ı仯����ı������������ ������ţ���
CO2(g) + H2(g)����Ӧ�����и����ʵ�Ũ������ͼt1ǰ��ʾ�仯���������¶Ȳ��䣬t2ʱ���������г���CO��H2��1mol��ƽ�⽫ �ƶ�������� �����ҡ���������t2ʱ�����ı䷴Ӧ����������H2Ũ�ȷ�������ͼt2����ʾ�ı仯����ı������������ ������ţ���


 ����ʾ�辧���е�һ��ԭ��,����������Ķ����á�
����ʾ�辧���е�һ��ԭ��,����������Ķ����á�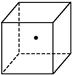
 Si(s)+4HCl(g),�÷�Ӧ�ķ�Ӧ�Ȧ�H=������kJ/mol��
Si(s)+4HCl(g),�÷�Ӧ�ķ�Ӧ�Ȧ�H=������kJ/mol�� 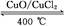 2Cl2+2H2O
2Cl2+2H2O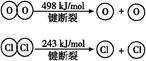
 CO(g)��H2(g)����H����131.3 kJ��mol��1��
CO(g)��H2(g)����H����131.3 kJ��mol��1�� 2NH3(g)����H����92.4 kJ��mol��1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯��ͼ����ʾ��
2NH3(g)����H����92.4 kJ��mol��1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯��ͼ����ʾ��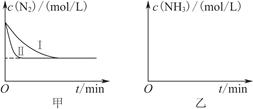
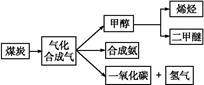
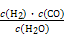 ,д��������Ӧ��Ӧ�Ļ�ѧ����ʽ:
,д��������Ӧ��Ӧ�Ļ�ѧ����ʽ:  CH3OH(g)
CH3OH(g)
 2NH3(g) ?H=bkJ/mol���仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���£�
2NH3(g) ?H=bkJ/mol���仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���£� CH3OH(g) ��H <0��
CH3OH(g) ��H <0��