题目内容
运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
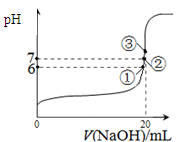
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:__________,b________(填“大于”“小于”或“等于”)0
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)_________(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ?H="-1266.8KJ/mol" ;②N2(g)+O2(g)=2NO(g) ?H=+180.5KJ/mol,写出氨高温催化氧化的热化学方程式: 。
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)
 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
①写出该反应的化学平衡常数的表达式:__________,b________(填“大于”“小于”或“等于”)0
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)_________(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ?H="-1266.8KJ/mol" ;②N2(g)+O2(g)=2NO(g) ?H=+180.5KJ/mol,写出氨高温催化氧化的热化学方程式: 。
(1)碱性;O2+2H2O+4e-=4OH- (2)①A ②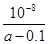 mol·L-1(或
mol·L-1(或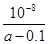 )
)
(3)①K=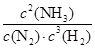 ;小于 ②小于
;小于 ②小于
(4)4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=-905.8 kJ/mol
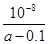 mol·L-1(或
mol·L-1(或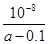 )
)(3)①K=
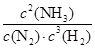 ;小于 ②小于
;小于 ②小于(4)4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=-905.8 kJ/mol
试题分析:(1)氨气的水溶液显碱性,所以根据燃料及反应原理可确定。电解质溶液应该选碱性。在该燃料电池中,燃料作负极,发生氧化反应,通入O2的电极作正极,正极上发生还原反应。电极反应为:O2+2H2O+4e-=4OH-。(2)① 若氨水与盐酸恰好发生反应,c(Cl-)=c(NH4+)。NH4+部分发生水解反应又有所消耗,使得溶液中的c(NH4+)<c(Cl-)。现在溶液中离子浓度关系满足c(NH4+)>c(Cl-)),说明氨水过量,盐酸布足量。因此正确选项为A. ② 根据溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+(OH-),由于溶液中c(NH4+)=c(Cl-),在25℃时c(H+)= (OH-)=10-7mol/L,
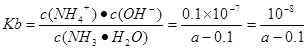 。(3) ① 化学平衡常数是可能反应达到平衡状态时个生成物的浓度幂指数的乘积与个反应物浓度的幂指数乘积的比。即K=
。(3) ① 化学平衡常数是可能反应达到平衡状态时个生成物的浓度幂指数的乘积与个反应物浓度的幂指数乘积的比。即K=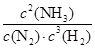 。由化学平衡常数K与温度的关系可知,升高温度,化学平衡向逆反应方向移动。根据平衡一定原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应。所以b<0. ②400℃时c(NH3)=6mol/L,c(N2)=4mol/Lc(H2)="2mol/L."
。由化学平衡常数K与温度的关系可知,升高温度,化学平衡向逆反应方向移动。根据平衡一定原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应。所以b<0. ②400℃时c(NH3)=6mol/L,c(N2)=4mol/Lc(H2)="2mol/L." 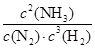 =
=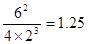 >0.5,所以化学平衡向逆反应方向移动。即此时刻该反应的v正(N2)<v逆(N2). ①+②×2,整理可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=-905.8 kJ/mol。
>0.5,所以化学平衡向逆反应方向移动。即此时刻该反应的v正(N2)<v逆(N2). ①+②×2,整理可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=-905.8 kJ/mol。
练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
 N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
 CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
 2H2O(l) ΔH="-285.8" kJ/mol
2H2O(l) ΔH="-285.8" kJ/mol N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。