题目内容
工业上常利用CO和H2合成可再生能源甲醇。
(1)已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)合成甲醇的方程式为CO(g)+2H2(g) CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。
在230 ℃?270 ℃最为有利。为研究合成气最合适的起始组成比n(H2):n(CO),分别在230 ℃、250 ℃和270 ℃进行实验,结果如下左图所示。其中270 ℃的实验结果所对应的曲线是_____(填字母);当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是 。
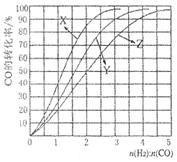
(3)当投料比为1∶1,温度为230 ℃,平衡混合气体中,CH3OH的物质的量分数为 (保留1位小数);平衡时CO的转化率 。
(1)已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)合成甲醇的方程式为CO(g)+2H2(g)
 CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。在230 ℃?270 ℃最为有利。为研究合成气最合适的起始组成比n(H2):n(CO),分别在230 ℃、250 ℃和270 ℃进行实验,结果如下左图所示。其中270 ℃的实验结果所对应的曲线是_____(填字母);当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是 。

(3)当投料比为1∶1,温度为230 ℃,平衡混合气体中,CH3OH的物质的量分数为 (保留1位小数);平衡时CO的转化率 。
(1)CH3OH (l) + O2(g) =" CO(g)" + 2H2O(l) ΔH=-443.5 kJ·mol-1
(2) Z 投料比越高,对应的反应温度越高 (3)33.3% 40%
(2) Z 投料比越高,对应的反应温度越高 (3)33.3% 40%
试题分析:(1)CO(g)燃烧的热化学方程式为CO(g)+1/2 O2(g)= CO2(g) ΔH=" —283.0" kJ/mol ; ① CH3OH(l) 燃烧的热化学方程式为CH3OH(l) +3/2 O2(g)= CO2(g)+ + 2H2O(l) ΔH=" —726.5" kJ/mol; ②. ②-①整理可得:CH3OH (l) + O2(g) =" CO(g)" + 2H2O(l) ΔH=-443.5 kJ/mol.(2) 合成甲醇的方程式为CO(g)+2H2(g)
 CH3OH(g) ΔH <0。由于该反应的正反应为放热反应,所以当反应达到平衡后,当n(H2)/n(CO)不变时,升高温度,化学平衡吸热反应 (即逆反应) 方向移动,CO的转化率降低,甲醇的产率也减小。因此这三个曲线中Z对应的是270 ℃的实验结果。这对合成甲醇的产率来说不利。但是温度过低,虽然产率高了,但反应速率太低,达到平衡所需要的时间太长,效率也不高。因此综上所述常采用在230 ℃?270 ℃最为有利。根据平衡移动原理,在其它条件不变时,增加某种反应物的浓度,能使平衡正向移动,使其它反应物的转化率提高,而其本身的转化率降低。当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是投料比越高,对应的反应温度越高。(3)n(H2)/n(CO)=1:1,假设n(H2)= n(CO)=1mol,有图像可知在230 ℃,当反应达到平衡时CO的转化率为40%,,根据反应的方程式CO(g)+2H2(g)
CH3OH(g) ΔH <0。由于该反应的正反应为放热反应,所以当反应达到平衡后,当n(H2)/n(CO)不变时,升高温度,化学平衡吸热反应 (即逆反应) 方向移动,CO的转化率降低,甲醇的产率也减小。因此这三个曲线中Z对应的是270 ℃的实验结果。这对合成甲醇的产率来说不利。但是温度过低,虽然产率高了,但反应速率太低,达到平衡所需要的时间太长,效率也不高。因此综上所述常采用在230 ℃?270 ℃最为有利。根据平衡移动原理,在其它条件不变时,增加某种反应物的浓度,能使平衡正向移动,使其它反应物的转化率提高,而其本身的转化率降低。当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是投料比越高,对应的反应温度越高。(3)n(H2)/n(CO)=1:1,假设n(H2)= n(CO)=1mol,有图像可知在230 ℃,当反应达到平衡时CO的转化率为40%,,根据反应的方程式CO(g)+2H2(g) CH3OH(g)可知:此时n(CO)="0.6mol," n(H2)=0.2mol,n(CH3OH) ="0.4mol," 在平衡混合气体中,CH3OH的物质的量分数为:0.4mol÷(0.6mol+0.2mol+0.4mol)×100%= 33.3%.
CH3OH(g)可知:此时n(CO)="0.6mol," n(H2)=0.2mol,n(CH3OH) ="0.4mol," 在平衡混合气体中,CH3OH的物质的量分数为:0.4mol÷(0.6mol+0.2mol+0.4mol)×100%= 33.3%.
练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
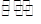 N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。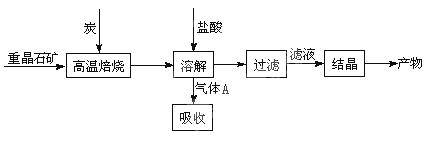
 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①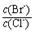 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】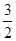 O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol
O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。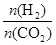 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。