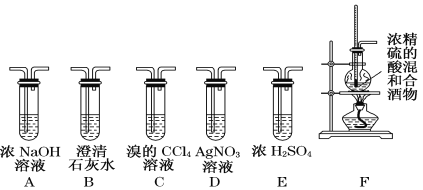
题目内容
【题目】浓度均为0.1mol·L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lgv/v0的变化关系如下图所示。下列叙述正确的是
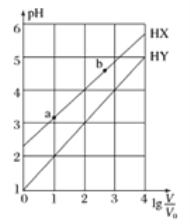
A. 常温下,由水电离出的c(H+)·c(OH-):a<b
B. HX、HY都是弱酸,且HX的酸性比HY的弱
C. 相同温度下,电离常数K( HX):a>b
D. lgv/v0 =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则![]() 减小
减小
【答案】A
【解析】A、加水稀释,对水的电离抑制减弱,促进水的电离,因此水电离出的c(H+)×c(OH-):a<b,故A正确;B、HX和HY两种酸的浓度均为0.1mol·L-1,根据图像,HX中c(H+)<0.1mol·L-1,属于弱酸,HY起始pH=1,说明HY是强酸,故B错误;C、电离平衡常数只受温度的影响,a到b,温度不变,电离平衡常数不变,即a=b,故C错误;D、HX是弱酸,其电离是吸热过程,加热促进电离,c(X-)增大,HY属于强酸,完全电离,c(Y-)不变,因此c(X-)/c(Y-)增大,故D错误。

 快乐小博士巩固与提高系列答案
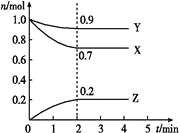
快乐小博士巩固与提高系列答案【题目】(双选)在1 L密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
| c(NH3) (mol/L) | c(O2) (mol/L) | c(NO) (mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
第10min | 0.7 | 1.475 | 0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1