��Ŀ����
����Ŀ����Ϊ��Ҫ����ԭ�ϣ��й㷺��;��
(1)�ϳɰ��е������������з�Ӧ��ȡ��
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H=+216.4KJ/mol
CO(g)+3H2(g) ��H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-41.2kJ/mol
CO2(g)+H2(g) ��H=-41.2kJ/mol
��ӦCH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ��H=______��
CO2(g)+4H2(g) ��H=______��
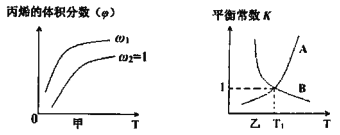
(2)��ʼʱͶ�뵪���������ֱ�Ϊ1mol��3mol���ڲ�ͬ�¶Ⱥ�ѹǿ�ºϳɰ���ƽ��ʱ������а�������������¶ȹ�ϵ��ͼ��
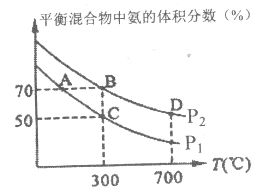
�ٺ�ѹʱ����Ӧһ���ﵽƽ��״̬�ı�־��______(�����)��
A.N2��H2��ת������� B.��Ӧ��ϵ�ܶȱ��ֲ���
C.![]() �ı�ֵΪ3:2 D.
�ı�ֵΪ3:2 D.![]() =2
=2
��P1______P2(����>������<������=������ͬ)����Ӧƽ�ⳣ����B��______D�㣻
��C��H2��ת����______��(��ֵ����0.1%)��A��B���������£��÷�Ӧ�ӿ�ʼ��ƽ��ʱ��������ƽ�����ʣ�v(A)______v(B)(����>������<������=��)��
(3)��֪25��ʱ��Na2SO3��NaHSO3�γɵĻ����Һǡ�ó����ԣ���û����Һ�и�����Ũ�ȵĴ�С˳��Ϊ______________(��֪25��ʱ��H2SO3�ĵ���ƽ�ⳣ��Ka1=1��10-2��Ka2=1��10-7)
���𰸡�CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ��H=+175.2kJ/mol B < > 66.7% < c(Na+)>c(HSO3-)=c(SO32-)>c(H+)=c(OH-)
CO2(g)+4H2(g) ��H=+175.2kJ/mol B < > 66.7% < c(Na+)>c(HSO3-)=c(SO32-)>c(H+)=c(OH-)
��������
(1)�������Ȼ�ѧ����ʽ���ӣ��Ϳɵõ���Ӧ��Ӧ���Ȼ�ѧ����ʽ��
(2)�ٸ��ݷ�Ӧ�ﵽƽ��ʱ�κ�һ��ֵ����ʲ��䣬���ʵ�Ũ�ȡ������Ȳ����ж�ƽ��״̬��
�ڸ÷�Ӧ�����������С�ķ�Ӧ�����¶Ȳ���ʱ������ѹǿ��ƽ�������ƶ������ĺ������ӣ���ѹǿ����ʱ�����ݸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����ж�B��D����Ļ�ѧƽ�ⳣ����С��
�۸���C��ʱ���ĺ�����50%����������ʽ����H2��ת���ʣ�����A��B������¶ȡ�ѹǿ�Ĵ�С���¶ȡ�ѹǿ�뻯ѧ��Ӧ���ʵ�Ӱ�������
(3)���������غ㡢����غ�����Ƚ�����Ũ�ȴ�С��
(1)a+b�������ɵ�CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) ��H=+175.2kJ/mol��
CO2(g)+4H2(g) ��H=+175.2kJ/mol��
(2)��A.N2(g)+3H2(g)![]() 2NH3(g)�ڸ÷�Ӧ��N2��H2��Ӧ�����ʵ����ı���1��3����������ʵ����ʵ����ı���1��3���������۷�Ӧ�Ƿ�ﵽƽ�⣬N2��H2��ת���ʶ���ȣ����ܾݴ��жϷ�ӦΪƽ��״̬��A����
2NH3(g)�ڸ÷�Ӧ��N2��H2��Ӧ�����ʵ����ı���1��3����������ʵ����ʵ����ı���1��3���������۷�Ӧ�Ƿ�ﵽƽ�⣬N2��H2��ת���ʶ���ȣ����ܾݴ��жϷ�ӦΪƽ��״̬��A����
B.�÷�Ӧ�Ƿ�Ӧǰ���������������ȵķ�Ӧ������ѹǿ�㶨���䣬����Ӧδ�ﵽƽ�⣬��������ͻᷢ���仯�����������������䣬�����ܶȾͻᷢ���仯��������ܶȲ��䣬��Ӧ�ﵽƽ��״̬��B��ȷ��
C.�����Ƿ�Ӧ���������������������٣�������Ȼ���ӣ����ֵ�ͻᷢ���仯����![]() �ı�ֵ����ʱ˵����Ӧ�ﵽƽ��״̬��������ֵΪ3��2ʱ����һ��˵����Ӧ����ƽ��״̬��C����
�ı�ֵ����ʱ˵����Ӧ�ﵽƽ��״̬��������ֵΪ3��2ʱ����һ��˵����Ӧ����ƽ��״̬��C����
D.�����Ƿ�Ӧ������������ֻҪ��ƽ�⣬���������٣����������ӣ����ֵ![]() �ͻᷢ���仯������ֵ����ʱ��˵����Ӧ����ƽ��״̬��������ֵΪ2ʱ����һ��˵�����ٱ仯�����Բ�һ����ƽ��״̬��D����
�ͻᷢ���仯������ֵ����ʱ��˵����Ӧ����ƽ��״̬��������ֵΪ2ʱ����һ��˵�����ٱ仯�����Բ�һ����ƽ��״̬��D����
�ʺ���ѡ����B��
�ڸ÷�Ӧ�����������С�ķ�Ӧ�����¶Ȳ���ʱ������ѹǿ��ƽ�������������С������Ӧ�����ƶ������ĺ������ӣ���ͼ��֪�����¶���ͬʱ��ѹǿΪP1ʱ��ƽ�������а����������С��ѹǿΪP2ʱ�����Ը���ͼʾ��֪ѹǿ��P2>P1����P1<P2��
�ϳɰ����ķ�Ӧ�Ƿ��ȷ�Ӧ����ѹǿ����ʱ�������¶ȣ���ѧƽ�������ȵ��淴Ӧ�����ƶ�����ѧƽ�ⳣ��ԽС��D����¶ȸ���B����¶ȣ����Ի�ѧƽ�ⳣ����B>D��
�� N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
��ʼ(mol) 1 3 0
ת��(mol)x 3x 2x
ƽ��(mol)1-x 3-3x 2x
����ƽ��ʱ������а����������Ϊ50%��![]() =50%�����x=2/3�����ڵ�����������Ӧ�����ʵ����ı���1:3����������ʵ����ʵ����ı���1:3�����Ե�����������ת������ȣ���Ϊ66.7%��
=50%�����x=2/3�����ڵ�����������Ӧ�����ʵ����ı���1:3����������ʵ����ʵ����ı���1:3�����Ե�����������ת������ȣ���Ϊ66.7%��
����ͼʾ��֪A��B����ƽ�������а��ĺ�����ͬ��B���¶Ⱥ�ѹǿ������A���¶Ⱥ�ѹǿ���¶����ߣ����ʼӿ죬ѹǿ�������ʼӿ죬������A��B���������µĻ�ѧ��Ӧ����V(A)<V(B)��
(3)��֪��25��ʱ��H2SO3�ĵ���ƽ�ⳣ��Ka1=1��10-2��Ka2=1��10-7����֪SO32-��ˮ��ƽ�ⳣ��Kh=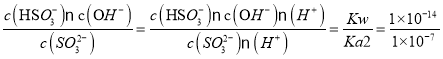 =1��10-7�����������غ��֪�ڸû����Һ��Na+Ũ�����֪Na2SO3��ˮ��̶Ⱥ�NaHSO3�ĵ���̶���ȣ�����c(HSO3-)=c(SO32-)����Na2SO3��NaHSO3�γɵĻ����Һǡ�ó����ԣ���Һ�����ԣ�c(H+)=c(OH-)���ε������������Ũ�ȴ���ˮ�������������Ũ�ȣ�����c(HSO3-)=c(SO32-)>c(H+)=c(OH-)����˸û����Һ������Ũ�ȴ�С��ϵΪ��c(Na+)> c(HSO3-)=c(SO32-)>c(H+)=c(OH-)��
=1��10-7�����������غ��֪�ڸû����Һ��Na+Ũ�����֪Na2SO3��ˮ��̶Ⱥ�NaHSO3�ĵ���̶���ȣ�����c(HSO3-)=c(SO32-)����Na2SO3��NaHSO3�γɵĻ����Һǡ�ó����ԣ���Һ�����ԣ�c(H+)=c(OH-)���ε������������Ũ�ȴ���ˮ�������������Ũ�ȣ�����c(HSO3-)=c(SO32-)>c(H+)=c(OH-)����˸û����Һ������Ũ�ȴ�С��ϵΪ��c(Na+)> c(HSO3-)=c(SO32-)>c(H+)=c(OH-)��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�