题目内容
【题目】中学化学中的一些常见物质有如图转化关系(部分产物未给出).其中A、H的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
回答下列问题.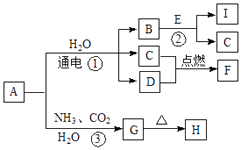
(1)D的电子式为 .
(2)H的化学式为
(3)写出反应①的化学方程式 .
(4)写出反应②的离子方程式 .
【答案】
(1)![]()
(2)Na2CO3
(3)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(4)2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
【解析】解:D气体在常温下呈黄绿色,则D为Cl2 , A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3 , H为Na2CO3 , 电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2 , I为NaAlO2 , F为HCl,(1)D为氯气,电子式为 ![]() ,故答案为:
,故答案为: ![]() ;(2)H的化学式为:Na2CO3 , 故答案为:Na2CO3;(3)反应①的化学方程式:2NaCl+2H2O
;(2)H的化学式为:Na2CO3 , 故答案为:Na2CO3;(3)反应①的化学方程式:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
D气体在常温下呈黄绿色,则D为Cl2 , A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3 , H为Na2CO3 , 电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2 , I为NaAlO2 , F为HCl.

【题目】氢氧化镁是一种用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面.镁硅酸盐矿石(主要成分Mg3Si2O5(OH)4 , 含氧化铝、氧化铁、氧化亚铁等杂质)可用于生产氢氧化镁,简要工艺流程如图1: 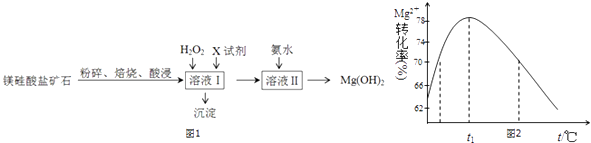
已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)对矿石焙烧的目的是 .
(2)加入H2O2溶液反应的离子方程式是 .
(3)向溶液Ⅰ中加入的X可以是 , 作用是 .
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示: ①溶液Ⅱ中发生反应的离子方程式是 .
②t1前Mg2+转化率增大的原因是;
t1后Mg2+转化率下降的原因是(用化学方程式表示) .