题目内容
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 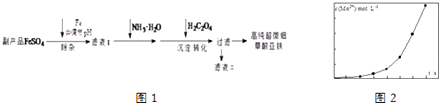
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为
【答案】
(1)NH3?H2O受热易分解,挥发出NH3 , Fe(OH)2受热也易分解
(2)(NH4)2SO4
(3)0.01mol
(4)生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快
【解析】解:(1)沉淀过程为一水合氨沉淀亚铁离子的过程,生成氢氧化亚铁,氢氧化亚铁不稳定,受热会分解,另外一水合氨受热也会分解,故反应温度不能太高,所以温度不宜过高的原因除了控制沉淀的粒径外,还有NH3H2O受热易分解,挥发出NH3 , Fe(OH)2受热易分解;
故答案为:NH3H2O受热易分解,挥发出NH3 , Fe(OH)2受热也易分解;(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵,所以副产品含有是(NH4)2SO4;
故答案为:(NH4)2SO4;(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000 molL﹣1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.40mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.40)=20mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣ , 所以n(C2O42﹣)= ![]() n(MnO4﹣)=20ml×10﹣3×0.2000molL﹣1×
n(MnO4﹣)=20ml×10﹣3×0.2000molL﹣1× ![]() =0.01mol;
=0.01mol;
故答案为:0.01mol;(4)从图象上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;
故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
副产品FeSO4(含Al(SO4)3和少量重金属离子)中加入铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀;(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3H2O受热易分解,挥发出NH3 , Fe(OH)2受热易分解;(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵;(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000 molL﹣1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.00)=20.4mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣ , 依据多步反应找关系式计算;(4)观察图象分析反应速率变大的因素,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣HCO3﹣等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
(1)火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示: 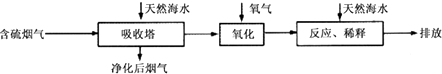
(i)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因 .
(ii)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(iii)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(iv)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 , 所得溶液中c(H+)﹣c(OH﹣)=(填字母编号).
A.c(SO32﹣)﹣c(H2SO3) B.c(SO32﹣)+c(NH3 . H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+) D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10﹣17 | 5.6×10﹣8 | 6.3×10﹣50 | 7.1×10﹣9 | 1.2×10﹣15 | 3.4×10﹣28 |
(i)你认为往废水中投入(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(ii)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= .
(iii)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1gmL﹣1).若环境要求排放标准为c(Ag+)低于1.0×10﹣8mol/L,问该工厂处理后的废水中c(Ag+)= . (已知KSP(AgCl)=1.8×10﹣10)
【题目】根据所给的信息和标志,判断下列说法不正确的是( )
A | B | C | D |
|
|
|
|
古代中国人已用麻黄治疗咳嗽 | 用于杀菌消毒和衣物的洗涤漂白 | 不可以用氢氧化钠溶液将其溶解 | 废纸、塑料、玻璃、金属均可回收 |
A.A
B.B
C.C
D.D