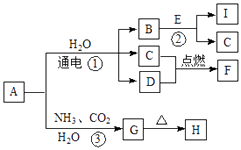
题目内容
【题目】如下图所示的甲、乙、丙三种晶体:

试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
【答案】(1)X2Y (2)1:2:1 (3)8
【解析】只需掌握晶体立方体中粒子实际占有“份额”的规律:顶点粒子在立方体中实占![]() ,立方体面上粒子实占
,立方体面上粒子实占![]() ,立方体棱边上粒子实占
,立方体棱边上粒子实占![]() ,立方体内部粒子占有1算1统计。
,立方体内部粒子占有1算1统计。
(1)甲中两个X原子位于立方体面心,算为1,Y位于立方体顶点,实际占有:![]() ×4=
×4=![]() 个,X:Y=1:
个,X:Y=1:![]() =2:1,所以甲的化学式为X2Y。
=2:1,所以甲的化学式为X2Y。
(2)乙中A占有:![]() ×8=1,B占有
×8=1,B占有![]() ×4=2,C占有1个,由此推出A:B:C=1:2:1。
×4=2,C占有1个,由此推出A:B:C=1:2:1。
(3)丙中D周围的E的个数与E周围D的个数相同,E周围有8个D,所以D周围有8个E。

【题目】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣HCO3﹣等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
(1)火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示: 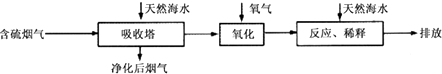
(i)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因 .
(ii)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(iii)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(iv)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 , 所得溶液中c(H+)﹣c(OH﹣)=(填字母编号).
A.c(SO32﹣)﹣c(H2SO3) B.c(SO32﹣)+c(NH3 . H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+) D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10﹣17 | 5.6×10﹣8 | 6.3×10﹣50 | 7.1×10﹣9 | 1.2×10﹣15 | 3.4×10﹣28 |
(i)你认为往废水中投入(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(ii)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= .
(iii)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1gmL﹣1).若环境要求排放标准为c(Ag+)低于1.0×10﹣8mol/L,问该工厂处理后的废水中c(Ag+)= . (已知KSP(AgCl)=1.8×10﹣10)