题目内容
【题目】二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)新的研究表明,利用太阳能可以将CO2分解制取炭黑,其原理如右图所示。该过程的能量转化形式为______,在整个过程中,FeO的作用是_________。
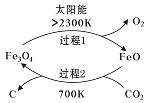
已知:
①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol
②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol 则过程2的热化学方程式为________。
(2)一定温度下,在密闭容器中进行反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
A.当混合气体的平均相对分子质量不变时,反应达到平衡状态
B.升高温度,加快反应速率,CO2的转化率降低
C.增大CO2的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、H2的体积分数不一定相等
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应CO2(g)+3H2(g)![]() CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比
CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比![]() 的关系如右图所示。
的关系如右图所示。
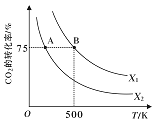
①若从反应开始到A点需要10s,则V(H2)= _____。
②该反应的平衡常数表达式为______,若X1=3,则B点的K=___________。
③根据图像判断X1 ____X2(填“>”、“<”或“=”,下同),平衡常数KA ___KB。
④若在500K时,按X1投料,在恒压下进行,达到平衡状态,此时CO2的转化率______75%(填“>”、“<”或“=”)
(4)美国伊利诺大学芝加哥分校(UIC)的研究团队设计出一种突破性的新太阳能电池,能把大气中的二氧化碳转换成碳氢化合物(hydrocarbon)燃料,解决了现代社会的两大挑战:“减少大气的碳含量”以及“有效率地制造高密度能源”。右图是通过CO2和H2O作用制备CH3OH的原理示意图。
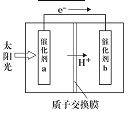
①a电极的名称_________,电极产物___________。
②b电极的电极反应为_________。
【答案】 太阳能转化成化学能 催化剂 6FeO(s)+CO2(g)![]() =2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol AD 0.225mol/Ls K=c(CH2OH)·c(H2O)/[c(CO2)·c3(H2)] 5.3 > > > 负极 H+、O2 CO2+6H++6e-=CH3OH+H2O
=2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol AD 0.225mol/Ls K=c(CH2OH)·c(H2O)/[c(CO2)·c3(H2)] 5.3 > > > 负极 H+、O2 CO2+6H++6e-=CH3OH+H2O
【解析】(1)从图中可以看出①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol吸收太阳能,转化为化学能,又已知②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol ,由-1×①-②得过程2的热化学方程式为 6FeO(s)+CO2(g)![]() =2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol ,从过程1和2中FeO先作反应物,后作生成物,FeO起催化剂的作用;(2)A、CO2(g)+CH4(g)
=2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol ,从过程1和2中FeO先作反应物,后作生成物,FeO起催化剂的作用;(2)A、CO2(g)+CH4(g)![]() 2CO(g)+2H2,反应物系数之和不等于生成物系数之和,只要平衡有所移动,势必会导致分子数的变化,所以当混合气体的平均相对分子质量一定,一定是平衡状态,故A正确;B、升高温度,加快反应速率,该反应是吸热反应,平衡正向移动,CO2的转化率升高,故B错误;C、增大CO2的浓度,平衡向正反应方向移动,但温度不变,平衡常数不变,故C错误;D、由于不清楚该反应的开始状态,所以平衡时CO、H2 的体积分数不一定相等,故正确。(3) ①由图像可知,CO2的转化率是0.75,则反应的CO2的物质的量为1.5mol,因此v(CO2)=1.5mol/(2L×10min)=0.075 mol/(L·s),换算成v(H2)= 0.225 mol/(L·s)。
2CO(g)+2H2,反应物系数之和不等于生成物系数之和,只要平衡有所移动,势必会导致分子数的变化,所以当混合气体的平均相对分子质量一定,一定是平衡状态,故A正确;B、升高温度,加快反应速率,该反应是吸热反应,平衡正向移动,CO2的转化率升高,故B错误;C、增大CO2的浓度,平衡向正反应方向移动,但温度不变,平衡常数不变,故C错误;D、由于不清楚该反应的开始状态,所以平衡时CO、H2 的体积分数不一定相等,故正确。(3) ①由图像可知,CO2的转化率是0.75,则反应的CO2的物质的量为1.5mol,因此v(CO2)=1.5mol/(2L×10min)=0.075 mol/(L·s),换算成v(H2)= 0.225 mol/(L·s)。
②若X1=3,则n=6,B 点时C(CH3OH)=C(H2O)=0.75mol·L-1,C(CO2)=0.25mol·L-1,C(H2)=0.75mol·L-1,用三段式进行计算可得出,K=5.3。
③根据图像可知,在等温时,X1 条件下CO2 的转化率大于在X2 条件下CO2 的转化率,说明X1>X2。随温度升高,CO2 的转化率减小,平衡逆向移动,说明正反应是放热的,B 点的温度比A 点高,所以平衡常数KA>KB。
④在500 K 时,恒容下,随反应的进行,压强减小,若在恒压下达到平衡状态,相当于对恒容下进行加压,平衡正向移动,此时CO2 的转化率变大。
(4)该电池的总反应为2CO2+4H2O=2CH3OH+3O2,可以将太阳能转变为化学能;①分析图像,由电子转移的方向可知,a 为负极,发生氧化反应:2H2O―4e―=O2+4H+ ;②b 为正极,发生还原反应:CO2+6H++6e-=CH3OH+H2O

 阅读快车系列答案
阅读快车系列答案