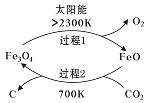
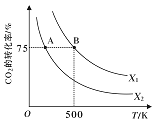
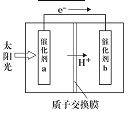
题目内容
【题目】有下列物:①乙醇、②苯酚、③乙醛、④丙烯酸(CH2=CHCOOH)、⑤乙酸乙酯。其中与溴水、酸性KMnO4溶液、NaHCO3溶液都能反应的是( )
A. ①③ B. ②⑤ C. ④ D. ③④
【答案】C
【解析】
试题①乙醇与溴水、NaHCO3溶液不能发生反应,错误;②苯酚与NaHCO3溶液不能发生反应,错误;③乙醛与NaHCO3溶液不能发生反应,错误;④丙烯酸(CH2=CHCOOH)与溴水发生加成反应,使溴水褪色;与酸性KMnO4溶液发生氧化还原反应,使酸性高锰酸钾溶液褪色;与NaHCO3溶液发生复分解反应产生CO2气体,正确;⑤乙酸乙酯与溴水、酸性KMnO4溶液、NaHCO3溶液都不能反应,错误。

【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第________周期,第______族;
(2)X可形成双原子分子,其分子的电子式是_________;Y和氢元素形成的10电子微粒中常见+1价阳离子为_______(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式__________。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_________________________。
(4)将0.20molYZ2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=________mol/(L·min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(YZ3)<_______mol。