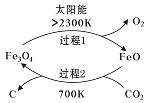
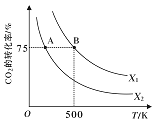
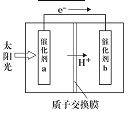
题目内容
【题目】MnO2在工业上具有广泛的用途,例如用作干电池去极剂、合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
I.在实验室中,可以用MnO2催化分解H2O2或KClO3制备O2。
(1)设计简单的实验验证MnO2对H2O2的分解起催化作用________。
(2)如果用MnO2催化分解KCIO3制备并收集O2,应选用的实验装置是_______。

若用B装置制备少量的NH3,则a中盛放的药品是_______。
II.MnO2是实验室中常见的氧化剂,某化学兴趣小组探究在常温下,MnO2能否氧化酸性NaI溶液。可选用的试剂和仪器有:0.5mol/LNaI溶液,稀硫酸、稀盐酸、CCl4、酒精、分液漏斗、烧杯、漏斗、玻璃棒、酒精灯、温度计、牛角管、锥形瓶、石棉网、铁架台(带铁圈、铁夹)。
实验的步骤如下:
①在小烧杯中加入15mLNaI溶液,加硫酸使其酸化,加适量的MnO2,充分搅拌。
②将所得溶液过滤,观察滤液颜色。
③向滤液中加入5mL萃取剂,充分振荡。
④置于铁架台铁圈上静置。
⑤分液。
⑥将下层得到的含I2溶液进行蒸馏使得到单质I2。
请回答下列问题:
(1)写出步骤①中发生的离子方程式___________。
(2)观察步骤②所得滤液的颜色为_______,初步判定有单质I2生成。
(3)萃取滤液中的碘单质所用的仪器名称为_______,选择的萃取剂是______。
(4)步骤④静置后,观察到的现象是_______。
(5)简述分液的操作:________。
(6)步骤⑥中组装蒸馏装置还缺少的仪器是___________。
【答案】 取适量H2O2溶液与试管中,观察,无明显现象,将带火星的木条伸入试管,不复燃;然后加入少量的MnO2粉末,产生大量气泡,将带火星的木条伸入试管,复燃。 AG 碱石灰或氢氧化钠固体或生石灰 2I-+4H++MnO2=I2+2H2O+Mn2+ 棕黄色 分液漏斗 四氯化碳 液体分成上下两层,上层几乎无色,下层为紫色 待液体分层后,将分液漏斗上的玻璃塞打开,或使活塞上的凹槽(或小孔)对准漏斗上的小孔,然后拧开漏斗颈上的旋塞,使下层液体缓缓流下,再将上层液体从伤口倒出。 蒸馏烧瓶、冷凝管
【解析】I.(1)设计简单的实验验证MnO2对H2O2的分解起催化作用,先要排除MnO2本身不分解产生O2,再对比H2O2分解加MnO2和不加MnO2的差别。取适量H2O2溶液与试管中,观察,无明显现象,将带火星的木条伸入试管,不复燃;然后加入少量的MnO2粉末,产生大量气泡,将带火星的木条伸入试管,复燃。(2)如果用MnO2催化分解KClO3制备并收集O2,是加热固体,用排水法收集O2,可选用A、G,若用B装置制备少量的NH3,用浓氨水滴到固体中,则a中盛放的药品是碱石灰或氢氧化钠固体或生石灰;
II.(1)步骤①中将NaI溶液酸化,用MnO2氧化,发生的离子方程式 2I-+4H++MnO2=I2+2H2O+Mn2+ ;(2)步骤②所得滤液是I2的水溶液,颜色为棕黄色;(3)萃取滤液中的碘单质所用的仪器名称为分液漏斗,萃取剂可用CCl4,不能用酒精,因为酒精和水互溶,不分层;(4)步骤④静置后,CCl4和水互不相溶,且CCl4密度大于水,所以观察到的现象是液体分成上下两层,上层几乎无色,下层为紫色;(5)分液的操作的步骤:待液体分层后,将分液漏斗上的玻璃塞打开,或使活塞上的凹槽(或小孔)对准漏斗上的小孔,然后拧开漏斗颈上的旋塞,使下层液体缓缓流下,再将上层液体从伤口倒出。(6)步骤⑥中组装蒸馏装置,铁架台,酒精灯,蒸馏烧瓶,温度计,冷凝器,长导管,牛角管,锥形瓶,石棉网,烧杯还缺少的仪器是蒸馏烧瓶、冷凝管。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第________周期,第______族;
(2)X可形成双原子分子,其分子的电子式是_________;Y和氢元素形成的10电子微粒中常见+1价阳离子为_______(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式__________。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_________________________。
(4)将0.20molYZ2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=________mol/(L·min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(YZ3)<_______mol。