��Ŀ����
����Ŀ�����ӹ�ҵ�ǹ���֧����ҵ֮һ��Ҳ�����˿�ѧ������չ��ҵ���������ӹ�ҵ������������Ϊ30%��FeCl3��Һ��ʴ����ͭ���ľ�Ե�壬�Ƴ�ӡˢ��·�壬������Ӧ�Ļ�ѧ����ʽΪ��2FeCl3+Cu�T2FeCl2+CuCl2 ��
��1�����鸯ʴ�����Һ���Ƿ���Fe3+ �� Ӧѡ�õ��Լ��� ��
��2��Ϊ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ���������Ƶô�����FeCl3��Һ��������ͼ��ʾʵ�鲽�裮���ڸ��ո��������ʵ��Ļ�ѧʽ��ʹʵ��ﵽԤ��Ŀ�ģ�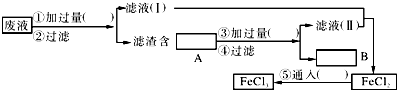
��3��д���йػ�ѧ��Ӧ�����ӷ���ʽ�� ��
���𰸡�
��1��KSCN��Һ
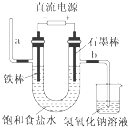
��2����ΪFe|��Ϊ����|��ΪCl2|AΪFe��Cu��BΪCu
��3��2Fe3++Fe�T3Fe2+ �� Fe+Cu2+�TFe2++Cu��Fe+2H+�TFe2++H2����2Fe2++Cl2�T2Fe3++2Cl��
���������⣺��1�����鸯ʴ�����Һ���Ƿ���Fe3+ �� Ӧѡ�õ��Լ���KSCN��Һ�����Դ��ǣ�KSCN��Һ����2��CuCl2��FeCl3�����۷�Ӧ����Fe2+��Cu����ҺI�к��Ȼ�������������A����Fe��Cu����ȥ���е�Feѡ�â�Ϊ�������ᣬ���˵õ���ҺII�к��Ȼ�������HCl��BΪCu�����Ȼ�������Һ��ͨ������������Ȼ��������ΪFe����Ϊ���ᣬ��ΪCl2 �� AΪFe��Cu��BΪCu�����Դ��ǣ���ΪFe����Ϊ�����ΪCl2��AΪFe��Cu��BΪCu����3���йػ�ѧ��Ӧ�����ӷ���ʽΪ2Fe3++Fe�T3Fe2+ �� Fe+Cu2+�TFe2++Cu��Fe+2H+�TFe2++H2����2Fe2++Cl2�T2Fe3++2Cl�� �� ���Դ��ǣ�2Fe3++Fe�T3Fe2+ �� Fe+Cu2+�TFe2++Cu��Fe+2H+�TFe2++H2����2Fe2++Cl2�T2Fe3++2Cl

 ��ǰ����ϵ�д�
��ǰ����ϵ�д�