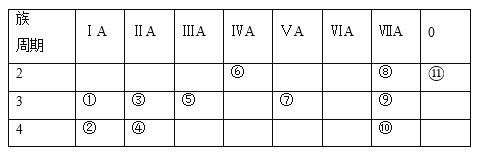
题目内容
【题目】(1)已知Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是________?
(2)已知Ksp[Mg(OH)2]=1.8×10-11,则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH为________?
(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是________?当Mg2+完全沉淀时,溶液的pH为________?
【答案】1.3×10-5mol·L-1 10.5 9.6 11.1
【解析】
(1)由AgCl(s)Ag+(aq)+Cl-(aq)
知c(Ag+)=c(Cl-)
所以Ksp(AgCl)=1.8×10-10=c(Ag+)·c(Cl-)=c2(Ag+)
解得c(Ag+)=1.3×10-5mol·L-1,
故答案为:1.3×10-5mol·L-1;
(2)由Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
知Ksp[Mg(OH)2]=1.8×10-11=c(Mg2+)·c2(OH-)=![]() ·c2(OH-)
·c2(OH-)
解得c(OH-)=3.3×10-4mol·L-1
所以c(H+)=![]() =3.0×10-11mol·L-1
=3.0×10-11mol·L-1
所以pH=10.5,
故答案为:10.5。
(3)由Ksp[Mg(OH)2]=1.8×10-11=c(Mg2+)·c2(OH-)=0.01·c2(OH-)
c(OH-)=4.2×10-5mol·L-1
c(H+)=![]() =2.4×10-10mol·L-1
=2.4×10-10mol·L-1
所以pH=9.6,即当pH=9.6时,开始出现Mg(OH)2沉淀。
由于一般认为残留在溶液中的离子浓度小于1×10-5mol·L-1时,沉淀已经完全,故Mg2+完全沉淀时有:
1×10-5·c2(OH-)=1.8×10-11
所以c(OH-)=1.34×10-3mol·L-1
c(H+)=![]() =7.46×10-12mol·L-1
=7.46×10-12mol·L-1
所以pH=11.1,
故答案为:9.6;11.1。