题目内容
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到平衡,用CO2表示该反应的平均速率ν(CO2)=________mol/(Lmin);
(2)平衡时氢气的物质的量浓度为_______mol/L;
(3)该条件下该反应的平衡常数K=_______;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_______;
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,平衡将_______(填“正向”、“逆向”或“不移动”)。
【答案】0.075 0.75 ![]() CD 逆向
CD 逆向
【解析】
根据v= ![]() 计算(1);根据三段式分析解答(2)(3);
计算(1);根据三段式分析解答(2)(3);
(4)要使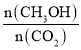 增大,应使平衡向正反应方向移动;
增大,应使平衡向正反应方向移动;
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,体积增大,平衡向气体体积增大的方向进行,据此分析判断。
(1)根据图像,二氧化碳浓度减小了0.75mol/L,则v(CO2)=![]() =0.075mol/(Lmin),故答案为:0.075;
=0.075mol/(Lmin),故答案为:0.075;
(2) CO2(g)+3H2(g)CH3OH(g)+H2O(g),
开始(mol/L): 1 3 0 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.750.750.75
氢气的平衡浓度为0.75mol/L,故答案为:0.75;
(3)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)要使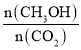 增大,应使平衡向正反应方向移动。A.因正反应放热,升高温度平衡向逆反应方向移动,则
增大,应使平衡向正反应方向移动。A.因正反应放热,升高温度平衡向逆反应方向移动,则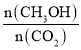 减小,故A错误;B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,
减小,故A错误;B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,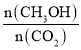 不变,故B错误;C.将H2O(g)从体系中分离,平衡向正反应方法移动,
不变,故B错误;C.将H2O(g)从体系中分离,平衡向正反应方法移动,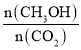 增大,故C正确;D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则
增大,故C正确;D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则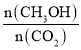 增大,故D正确;故答案为:CD;
增大,故D正确;故答案为:CD;
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,体积增大,平衡向气体体积增大的方向进行,CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡逆向进行,故答案为:逆向。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。