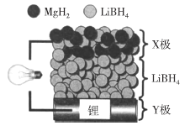
题目内容
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A.15g甲基(-CH3)中含有的电子数为9NA
B.标准状况下,2.24L辛烷中所含碳原子数为0.8NA
C.1.8gH2O与D2O的混合物中含有的质子数和电子数均为NA
D.—定条件下,密闭容器中2molSO2(g)与1molO2(g)充分反应,则容器中分子数为2NA
【答案】A
【解析】
A .15g甲基的物质的量都是1mol,1mol甲基中含有9mol电子,含有的电子数为9NA,选项A正确;
B.在标准状况下,辛烷不是气体,无法计算22.4L辛烷的物质的量,也就无法计算辛烷中含碳原子数目,选项B错误;
C.1.8g![]() 的物质的量=
的物质的量=![]() =0.1mol,1.8g D2O的物质的量=
=0.1mol,1.8g D2O的物质的量=![]() =0.09mol,所以1.8gH2O与D2O的混合物中含有的质子数和电子数不能确定,选项C错误;
=0.09mol,所以1.8gH2O与D2O的混合物中含有的质子数和电子数不能确定,选项C错误;
D.二氧化硫和氧气的反应为可逆反应,故容器中分子数大于2NA,选项D错误。
答案选A。

【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①⑩十种元素在周期表中的位置。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑥ | ⑨ | |||
4 | ② | ⑦ | ⑩ |
(1)①~⑩中金属性最强的元素为____________(写名称)。
(2)①、⑧两种元素形成的化合物,在高温下灼烧,火焰呈____________色。
(3)⑦、⑨两种元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(4)①、⑥、⑧、⑨四种元素形成的简单离子半径由大到小的顺序依次是____________span>。(用微粒符号来表示)
(5)⑤元素的氢化物实验室制法的化学方程式是____________。
(6)⑤、⑨的气态氢化物在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(7)下列说法正确的是____________(填字母)。
a.⑥的非金属性强于⑦ b.氢化物稳定性:⑦<⑩ c.③单质与水反应比单质①剧烈