题目内容
【题目】检验某溶液中是否含有![]() ,常用的方法是( )
,常用的方法是( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不落于水的白色沉淀生成
C.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不落于水的白色沉淀生成
D.取样,滴加稀盐酸,无明显现象,再滴加BaCl2落液,看是否有不溶于水的白色沉淀生成
【答案】D
【解析】
A. 直接滴加BaCl2溶液不能排除银离子、碳酸根离子、亚硫酸根离子等的干扰,故A错误;
B. 滴加稀盐酸酸化的BaCl2溶液,不能排除银离子的干扰,故B错误;
C. 滴加稀硫酸,再滴加BaCl2溶液,加入的硫酸会与氯化钡生成白色沉淀,不能证明原溶液中是否有SO42存在,故C错误;
D. 先加入稀盐酸,无明显现象,没有产生沉淀,排除银离子、碳酸根、亚硫酸根的干扰,然后再加氯化钡,产生白色沉淀,则证明有SO42存在,故D正确;
故选D。

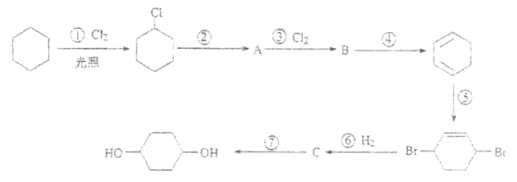
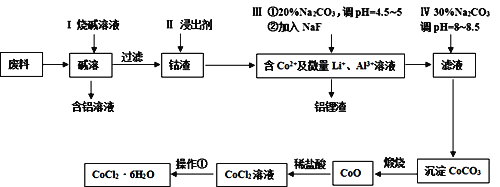
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
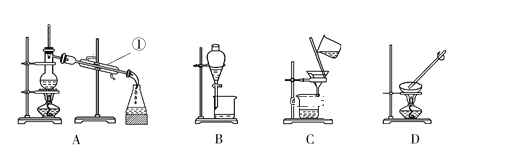
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |