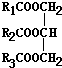题目内容
某金属重4g,其原子核外有2mol电子,核内共有1.204×1024个中子,该金属与足量盐酸反应,有0.2mol电子发生转移,生成了6.02×1022个阳离子.
(1)该金属元素符号是 ,摩尔质量是 .
(2)原子核内有 个质子, 个中子.
(1)该金属元素符号是
(2)原子核内有
考点:质量数与质子数、中子数之间的相互关系,物质的量的相关计算
专题:原子组成与结构专题
分析:6.02×1022个阳离子说明金属的物质的量为0.1mol,则原子中电子数为
=20,中子数为
=20,再根据M=
求出摩尔质量,摩尔质量在数值上近似等于质量数,利用质子数+中子数=质量数求出质子数,从而确定原子序数和元素符号.
| 2mol |
| 0.1mol |
| ||
| 0.1mol |
| m |
| n |
解答:
解:解:6.02×1022个阳离子说明金属的物质的量为0.1mol,则原子中电子数为
=20,中子数为
=20,摩尔质量M=
=
=40g/mol,摩尔质量在数值上近似等于质量数,所以质量数为40,质子数为40-20=20,则元素符号为Ca;
故答案为:(1)Ca;40g/mol;
(2)20;20;
| 2mol |
| 0.1mol |
| ||
| 0.1mol |
| m |
| n |
| 4g |
| 0.1mol |
故答案为:(1)Ca;40g/mol;
(2)20;20;
点评:本题考查学生原子原子中的质子数、中子数以及电子数之间的关系,可以根据所学知识回答,较简单.

练习册系列答案
相关题目
某化合物的结构(键线式)及球棍模型分别如图所示.下列关于该有机物的叙述正确的是( )
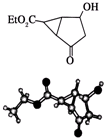

| A、该有机物的核磁共振氢谱有6个吸收峰 |
| B、该有机物属于芳香化合物 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应 |
原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子.请写出A2+在基态时外围电子(价电子)排布式为 ,B元素在周期表中的位置为 .
下列属于加成反应的是( )
A、CCl4+H2
| |||
B、2CH2=CH2+O2
| |||
C、 +HNO3 +HNO3
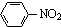 +H2O +H2O | |||
D、 +3H2 +3H2
 |