题目内容
在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物R?nH2O的质量为 Wg.
(1)求原饱和溶液中溶质的质量分数.(只列算式不必计算结果)
(2)求从原饱和溶液中析出溶质的质量.(用代数式表示)
(3)若R的相对分子质量为M,求n的值(只列算式不必化简) .
(1)求原饱和溶液中溶质的质量分数.(只列算式不必计算结果)
(2)求从原饱和溶液中析出溶质的质量.(用代数式表示)
(3)若R的相对分子质量为M,求n的值(只列算式不必化简)
考点:溶液中溶质的质量分数及相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据溶解度的概念来求,原饱和溶液中溶质的质量分数;
(2)向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物R?nH2O的质量为 Wg,得到的溶液仍然是此温度下的饱和溶液;
(3)根据 Wg结晶水合物R?nH2O中的水和从原饱和溶液中析出溶质构成饱和溶液,来求解.
(2)向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物R?nH2O的质量为 Wg,得到的溶液仍然是此温度下的饱和溶液;
(3)根据 Wg结晶水合物R?nH2O中的水和从原饱和溶液中析出溶质构成饱和溶液,来求解.
解答:
解:(1)原饱和溶液中溶质的质量分数为:
×100%,故答案为:
×100%;
(2)向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物R?nH2O的质量为 Wg,可知原饱和溶液质量减少(W-B)g,减少的溶液是饱和溶液,则析出溶质的质量为:
×(W-B)g,故答案为:
×(W-B)g;
(3)向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物R?nH2O的质量为 Wg,可知原饱和溶液质量减少(W-B)g,减少的溶液是饱和溶液,则析出溶剂的质量为:
×(W-B),物质的量为
,结晶水合物中溶质的物质的量为
,所以n=
÷
,故答案为:
÷
.
| 23 |
| 100+23 |
| 23 |
| 100+23 |
(2)向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物R?nH2O的质量为 Wg,可知原饱和溶液质量减少(W-B)g,减少的溶液是饱和溶液,则析出溶质的质量为:
| 23 |
| 123 |
| 23 |
| 123 |
(3)向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物R?nH2O的质量为 Wg,可知原饱和溶液质量减少(W-B)g,减少的溶液是饱和溶液,则析出溶剂的质量为:
| 100 |
| 123 |
| ||
| 18 |
B+
| ||
| M |
| 100(W-B) |
| 18×123 |
B+
| ||
| M |
| 100(W-B) |
| 18×123 |
B+
| ||
| M |
点评:本题溶解度的相关计算,结合质量分数和概念的考查,比较容易.

练习册系列答案
相关题目
下列物质中,属于混合物的是( )
| A、碳酸钠 | B、液态氨 |
| C、铝热剂 | D、氢氧化钠 |
近年,科学家人工合成了位于元素周期表中第七周期第ⅦA族的两种核素
Uus和
Uus,下列说法不正确的是( )
293 117 |
294 117 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
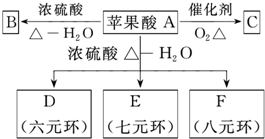 苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸.该苹果酸在分离提纯后的化学分析如下:
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸.该苹果酸在分离提纯后的化学分析如下: SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L.
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L.