题目内容
原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子.请写出A2+在基态时外围电子(价电子)排布式为 ,B元素在周期表中的位置为 .
考点:原子结构与元素的性质
专题:原子组成与结构专题
分析:原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则只能是第VIII族元素,原子序数B比A多1,基态B原子中含有三个未成对电子,B是Co元素,则A是Fe元素,再根据构造原理书写A2+在基态时外围电子排布式、结合核外电子层数确定B元素在周期表中的位置.
解答:
解:原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则只能是第VIII族元素,原子序数B比A多1,基态B原子中含有三个未成对电子,B是Co元素,则A是Fe元素,A原子核外有26个电子,其最外层有2个电子,失去两个4s、1个3d电子生成A2+,3d电子为A2+价电子,根据构造原理知A2+的基态外围电子排布式为3d6,B元素核外有4个电子层且位于第VIII族,所以B位于第四周期第VIII族,故答案为:3d6;第四周期Ⅷ族.
点评:本题考查了原子结构和元素性质,明确元素周期表及原子结构是解本题关键,根据“周期表中既处于同一周期又位于同一族”确定元素所处族,再结合未成对电子确定元素,题目难度中等.

练习册系列答案
相关题目
在下列溶液中,能大量共存的一组离子是( )
| A、pH=1的溶液中:NH4+、Fe2+、SO42-、ClO- |
| B、通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C、c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D、通入过量CO2气体的溶液中:Na+、Ba2+、HCO3-、Cl-、Br- |
下列说法不正确的是( )
| A、气相色谱法可用于分离结构相近、性质相似的物质 |
| B、做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,立即用蒸馏水洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中 |
| C、受溴腐蚀至伤,先用苯或甘油洗伤口,再用大量水冲洗 |
| D、向5mL 0.1mol/L KI中加入0.1mol/L FeCl3溶液5-6滴,再加入2mL CCl4振荡后分液,向水层中加入苯酚溶液呈现紫色 |
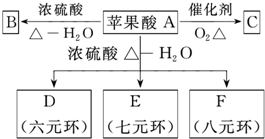 苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸.该苹果酸在分离提纯后的化学分析如下:
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸.该苹果酸在分离提纯后的化学分析如下: