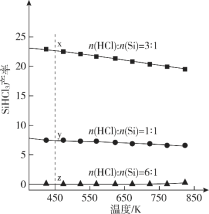
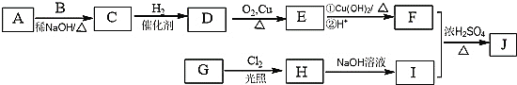
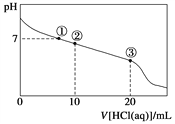
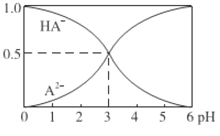
题目内容
【题目】下列说法正确的是
A. 反应 2Mg+CO2 ![]() 2MgO+C△H<0 从熵变角度看,可自发进行
2MgO+C△H<0 从熵变角度看,可自发进行
B. 在密闭容器发生可逆反应:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H 变小
C. 根据 HClO 的 Ka=3.0×108,H2CO3 的 Ka1=4.3×107,Ka2=5.6×1011,可推测相同状况 下,等浓度的 NaClO 与 Na2CO3 溶液中,pH 前者小于后者
D. 已知:Ksp(AgCl)=1.8×1010,Ksp(Ag2CrO4)=2.0×1012,将等体积浓度为1.0×10﹣4mol/L 的 AgNO3 溶液滴入到浓度均为 1.0×10﹣4mol/L 的 KCl 和 K2CrO4 的混合溶液中产生两种不同沉淀,且 Ag2CrO4 沉淀先产生
【答案】C
【解析】
A、反应的△S<0,从熵变角度看不利于反应的自发进行;
B、平衡发生移动,反应热不变;
C、酸越弱,对应的盐的碱性越强;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀。
A项、反应的△S<0,从熵变角度看不利于反应的进行,反应能否自发进行,应满足△H-T△S<0,故A错误;
B项、达到平衡后,保持温度不变,缩小容器体积,平衡发生移动,反应热不变,故B错误;
C项、由电离常数可知,酸越弱,对应的盐的碱性越强,故C正确;
D项、将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度为1.0×10-4mol/L的K2CrO4的混合溶液,c(Ag+)=5.0×10-5mol/L,则c2(Ag+)×c(CrO42-)=2.5×10-13,则没有生成Ag2CrO4沉淀,如生成沉淀,则Cl-先沉淀,故D错误。
故选C。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】t℃时,在一个体积为2L密闭容器中加入反应物A、B,发生如下反应:A(s)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质 | 起始 | 2分钟 | 4分钟 | 6分钟 |
A | 2 mol | 1.2 mol | ||
B | 6 mol | 3.0 mol | ||
C | 0 mol | x mol | 4.5 mol |
A. 前2分钟内,A的反应速率为0.2molL-1min-1
B. 表中x的值为3.6
C. 4分钟时,反应达到平衡状态,此时正、逆反应的速率都为0
D. 升高温度,正、逆反应的速率都会增大