题目内容
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA
C. 11.2LCO2中含有的分子数为0.5NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA
【答案】D
【解析】
A、根据n=![]() 并结合D2O、H2O中的电子数来计算;18g水的物质的量为1mol,水中含有10个质子,18gD2O物质的量不是1mol,含质子数不是1mol,含有质子数不同,选项A错误;
并结合D2O、H2O中的电子数来计算;18g水的物质的量为1mol,水中含有10个质子,18gD2O物质的量不是1mol,含质子数不是1mol,含有质子数不同,选项A错误;
B、0.1mol/L的NaCl溶液中,Na+与Cl-离子的浓度为0.1mol/L,离子数目与离子浓度、溶液体积有关,未告诉溶液体积,无法计算离子数目,选项B错误;
C、二氧化碳所处的状态不明确,不一定是标况,故11.2L二氧化碳的物质的量不一定是0.5mol,选项C错误;
D、标况下5.6L二氧化碳的物质的量为0.25mol,而过氧化钠与二氧化碳反应时,当1mol二氧化碳参与反应时,转移1mol电子,故0.25mol二氧化碳转移0.25mol电子即0.25NA个,选项D错误;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】锰是一种非常重要的金属元素,在很多领域有着广泛的应用。利用废铁屑还原浸出低品位软锰矿制备硫酸锰,然后进行电解,是制备金属锰的新工艺,其流程简图如下:
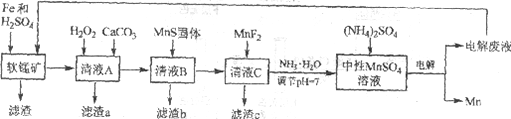
已知:
i. 低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等。
ii. 部分金属离子以氢氧化物沉淀时的pH
Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ | |
开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii. 几种化合物的溶解性或溶度积(Ksp)
MnF2 | CaS | MnS | FeS | CuS |
溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为span>Fe3+的离子方程式是____________。
(2)清液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH≈5。滤渣a的主要成分中有黄铵铁矾NH4Fe3(SO4)2(OH)6。
①H2O2的作用是____________(用离子方程式表示)。
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生x的原因:____________。
(3)用离子方程式表示MnS固体的作用:____________。
(4)滤渣c的成分是____________。
(5)如下图所示装置,用惰性电极电解中性MnSO4溶液可以制得金属Mn。阴极反应有:
i. Mn2++2e-=Mn ii. 2H++2e-=H2↑
电极上H2的产生会引起锰起壳开裂,影响产品质量。
①电解池阳极的电极方程式是________________。
②清液C需要用氨水调节pH=7的原因是____________。
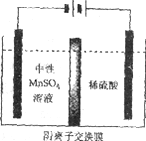
③电解时,中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有___________(结合电极反应式和离子方程式解释)。