题目内容
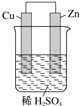
【题目】铅蓄电池的工作原理为Pb+PbO2+2H2SO4===2PbSO4+2H2O。下列判断不正确的是
A. 充电时正极的电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO![]()
B. 当电路中转移0.2 mol电子时,电池中消耗的H2SO4为0.2 mol
C. 铅蓄电池充电时SO![]() 向Pb电极迁移
向Pb电极迁移
D. 铅蓄电池充电时,铅电极应接外加电源的负极
【答案】C
【解析】A、充电时电池正极为阳极,发生氧化反应,充电时正极发生的电极反应为PbSO4+2H2O-2e-===PbO2+4H++SO42-,A正确;B、根据方程式可判断,当电路中转移0.2mol电子时,消耗的H2SO4为0.2mol,B正确;C、电解池中阴离子移向阳极,因此铅蓄电池充电时SO42-向PbO2电极迁移,C错误;D、充电相当于是放电的逆反应,充电时负极发生还原反应作阴极,因此铅蓄电池充电时,铅电极应接外加电源的负极,D正确。答案选C。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目